Органические ионы и радикалы.
Органические катионы, анионы и свободные радикалы являются неустойчивыми промежуточными частицами.
Относительная устойчивость и, следовательно, вероятность образования той или иной частицы определяются возможностью рассредоточения (делокализации) заряда в ионе или неспаренного электрона в радикале.
Чем больше рассредоточен заряд в ионе или неспаренный электрон в радикале, тем меньшим запасом энергии обладают эти частицы и тем они стабильнее. Возможность делокализации электронов в ионе или радикале зависит от их строения и определяется влиянием атомов и атомных групп (электронными эффектами заместителей), связанных с атомом, несущим заряд или неспаренный электрон.
От устойчивости промежуточных частиц зависит направление реакции.
Чем ниже энергия промежуточной частицы (т.е. больше устойчивость), тем меньше энергия активации ее образования. Это в значительной степени определяет направление реакции в соответствии с правилом:
реакция идет через образование наиболее устойчивых промежуточных частиц.
Радикальные реакции.
Реакции, в которых происходит гомолитический разрыв связей и образуются свободно-радикальные промежуточные частицы, называются радикальными реакциями.
Пример - реакция радикального замещения при хлорировании метана:
Общая схема реакции: CH4 + Cl2 ® CH3Cl + HCl
Стадии процесса:
Cl2 ® 2 Cl· (на свету)
Cl· + H–CH3 ® HCl + ·CH3
·CH3 + Cl2 ® CH3Cl + Cl· и так далее.
Механизм радикального замещения обозначается символом SR (по первым буквам английских терминов: S – substitution [замещение], R – radical [радикал]).
Реакции с участием свободных радикалов характерны для соединений с неполярными и слабополярными связями.
Такие связи (например, C–C, C–H, Cl–Cl, O–O и т.п.) склонны к гомолитическому разрыву.
Условия проведения радикальных реакций:
1) повышенная температура (часто реакцию проводят в газовой фазе),
2) действие света или радиоактивного излучения,
3) присутствие соединений - источников свободных радикалов (инициаторов),
4)неполярные растворители.
Ионные реакции.
Реакции, в которых происходит гетеролитический разрыв связей и образуются промежуточные частицы ионного типа, называются ионными реакциями.
Такие реакции характерны для соединений с полярными связями (C-O, C-N, C-Cl) и связями с высокой поляризуемостью (C=C, C=C-C=C, C=O и т.п.), благодаря их склонности к гетеролитическому разрыву.
Пример ионной реакции - гидролиз 2-метил-2-хлорпропана (триметилхлорметана, трет-бутилхлорида)
Общая схема реакции:
(CH3)3C-Cl + H2O ® (CH3)3C-OH + HCl
Стадии процесса:
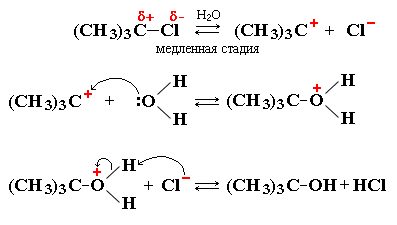
Органические катионы и анионы - неустойчивые промежуточные частицы. В отличие от неорганических ионов, постоянно присутствующих в водных растворах и расплавах, они возникают только в момент реакции и сразу же вступают в дальнейшие превращения.
Условия ионных реакций:
1) невысокая температура;
2) полярные растворители, способные к сольватации образующихся ионов.
Действие света или радиоактивного излучения не влияет на скорость ионных реакций.
По характеру реагента, действующего на молекулу, ионные реакции делятся на электрофильные и нуклеофильные.
Дата добавления: 2015-11-06; просмотров: 3039;
