Индуктивное влияние. Индукционный эффект.
Смещение электронов σ – связей обозначают как индуктивный эффект. Понятие индукционного эффекта предложено Дж. Льюисом.
Индуктивный эффект (I – эффект) – это смещение электронной плотности в молекулах по цепи σ – связей вследствие различной электроотрицательности атомов, участвующих в образовании этих связей.
Индукционный эффект состоит в передаче влияния путем последовательной поляризации σ – связей и распространяется вдоль цепи связанных атомов:
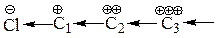
Подобные смещения электронных пар распространяются далее по цепи простых σ – связей.
В монохлоруксусной кислоте электронный сдвиг связи Cl  H передается по цепочке простых связей до карбоксильной группы и связи О – Н, вызывая увеличение ее полярности, а следовательно, подвижности атома водорода и кислотных свойств:
H передается по цепочке простых связей до карбоксильной группы и связи О – Н, вызывая увеличение ее полярности, а следовательно, подвижности атома водорода и кислотных свойств:
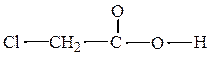
Характерная особенность индуктивного механизма передачи влияния атомов в молекуле состоит в том, что все смещаемые электронные пары σ – связей остаются в своих первоначальных октетах. Изменения касаются лишь их положения относительно связанных атомов.
Силу индуктивного эффекта функциональных групп и атомов оценивают, сравнивая его с индуктивным эффектом группы, которую принимают за стандарт. В качественных оценках за стандарт часто принимают атом водорода. Количественно силу индуктивного эффекта различных групп оценивают по сравнению с метильной группой, которую принимают за стандарт.
Группы и атомы, оттягивающие электроны σ – связи от углерода, называют электроноакцепторными (ЭА). Их индуктивный эффект обозначается символом «–I» и называется отрицательным. – I-Эффект проявляют атомы, имеющие полный или частичный положительный заряд и более электроотрицательные, чем углерод. Например, в соединениях:
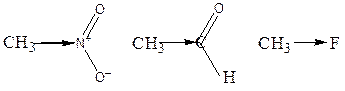
группы NO2 , CHO, F проявляют – I-эффект. Величина – I-эффекта зависит от электроотрицательности атомов, связанных с углеродом. Например, – I-эффект падает в ряду:
F > Cl > Br > I; F > OH > NH2
Атомы и группы атомов, вызывающие смещение электронов σ – связи к углероду, называются электронодонорными (ЭД). Индуктивный эффект таких групп обозначается символом «+I» и называется положительным. +I-Эффект проявляют атомы, несущие полный отрицательный заряд, металлы и алкильные группы. Например:
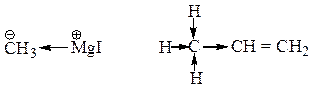
Mg в метилмагниййодиде и группа СН3 в пропене проявляют +I-эффект. +I-Эффект алкильных групп возрастает в ряду:
метил < этил < пропил < изопропил < трет-изобутил
то есть с накоплением метильных групп у атома углерода.
Наиболее сильное влияние индуктивный эффект оказывает на соседний атом и быстро затухает по цепи простых связей. Влияние заместителя с удалением на 3 – 4 С – С –связи становится малозаметным.
Сравнение кислотных свойств карбоновых кислот и их производных
| Соединение | Направление I-Эффекта | Константа диссоциации |
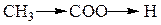
| +I | 1,76 * 10–5 |
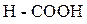
| I = 0 | 17,72 * 10–5 |
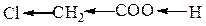
| –I | 135,9 * 10–5 |
Сила индукционного эффекта зависит от природы заместителя, а именно, от его электроноакцепторных или электронодонорных свойств. Для электроноакцепторных заместителей – I-эффект возрастает с электроотрицательностью атома и увеличением числа электроотрицательных атомов.
Электроотрицательность атомов галогенов возрастает от йода к фтору. Это, как правило, усиливает вызываемый ими – I-эффект, и увеличиваются кислотные свойства галогенозамещенных карбоновых кислот.
Ненасыщенные группы обнаруживают слабый – I-эффект. Причина такой зависимости состоит в увеличении электроотрицательности атома углерода, связанного с изменением его гибридизации.
Насыщенные алкильные радикалы вызывают слабый +I-эффект. При этом +I-эффект алкильного радикала возрастает с увеличением длины цепи и ее разветвленности: уксусная кислота более сильная чем бутановая.
Кислотные свойства галогенозамещенных карбоновых кислот
| Соединение | Константа диссоц. | Соединение | Константа диссоц. |
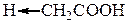
| 0,176 * 10–4 | 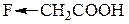
| 20,00 * 10–4 |
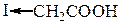
| 6,68 * 10–4 | 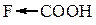
| 25,96 * 10–4 |
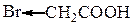
| 12,53 * 10–4 | 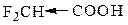
| 570,00 * 10–4 |
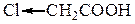
| 13,59 * 10–4 | 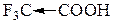
| 5000,00 * 10–4 |
Дата добавления: 2015-11-06; просмотров: 2781;
