Химические реакции и физические превращения
Воздействие на обрабатываемую деталь концентрированными потоками энергии приводит к структурным превращениям в ее поверхностном слое (рис.8.1) и химическим реакциям в ванне расплава (рис.8.2).
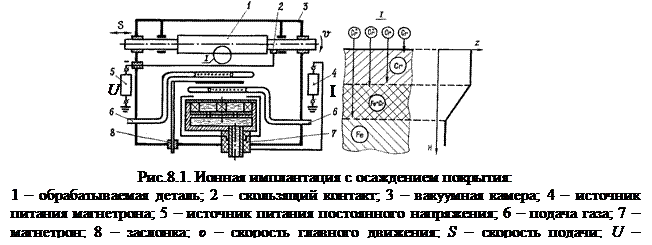 | |||
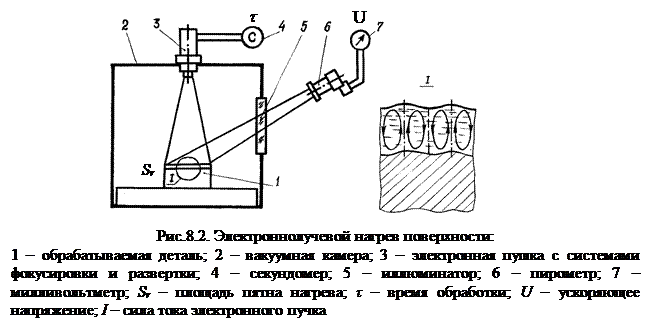 |
Изучение физико-химических превращений складывается из анализа стехиометрических соотношений уравнения равновесия и описания кинетических закономерностей.
Стехиометрическое уравнение является кратким выражением материального баланса реакции:
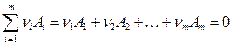 , (8.1)
, (8.1)
где 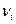 - стехиометрические коэффициенты, для исходных веществ
- стехиометрические коэффициенты, для исходных веществ 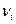 <0, для продуктов реакции
<0, для продуктов реакции 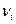 >0, Аi – символы веществ участвующих в реакции.
>0, Аi – символы веществ участвующих в реакции.
Расчет физико-химического равновесия позволяет выявить возможность получения тех или иных веществ в требуемых количествах, а также оценить содержание в них примесей и побочных веществ. Существует несколько методов термодинамического анализа сложных систем. Простейшие основаны на решении системы уравнений, образованных выражениями для констант равновесия, совместно с уравнениями стехиометрического баланса (8.1). Для многокомпонентных гетерогенных систем, к которым в первую очередь относятся технологические системы, применяются методы основанные на использовании принципов максимума энтропии и минимума свободной энергии Гиббса.
Кинетика реакций и превращений описывается скоростью wr изменения массы реагентов М в единице объема V для гомогенных реакций
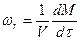
или на единицу поверхности Sr для гетерогенных процессов
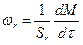 .
.
Зависимость скорости реакции от концентрации реагирующих веществ
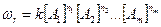 ,
,
где ni – порядок реакции по веществу Аi, (i=1, 2, …, m), k – константа скорости процесса, выражаемая через энергию активации Е уравнением Аррениуса:
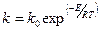
здесь k0 – предэкспоненциальный множитель, R – универсальная газовая постоянная, Т – абсолютная температура.
Лекция №9
Дата добавления: 2015-11-06; просмотров: 910;
