Предмет и методы молекулярной физики.
Молекулярная физика представляет собой раздел физики, изучающий строение и свойства вещества, исходя и так называемых молекулярно-кинетических представлений. Согласно этим представлениям любое тело (твердое, жидкое, газообразное) состоит из большого количества весьма малых обособленных частиц – молекул (атомы можно рассматривать как одноатомные молекулы).
Это представление возникло ещё в глубокой древности и было отчетливо высказано греческим философом Демокритом (Vв. до н.э.). Однако в дальнейшем эти атомистские воззрения были забыты и возрождены лишь во второй половине XVIIв. Бойлем, а затем в 18-19в.в. разработаны Ломоносовым, Дальтоном, Кренигом, Больцманом, Максвеллом и др. в качестве научной теории, получившей название молекулярно-кинетической теории.
Основоположником этой теории является Ломоносов, который впервые заявил, что любое тело состоит из мельчайших частиц – корпускул, имеющих форму шара с шероховатой поверхностью. При движении эти частицы сталкиваются друг с другом и из-за шероховатости приобретают вращательное движение. Т.е. Ломоносов высказал мысль о том, что молекулы движутся не только поступательно, но и вращательно. Этим самым он опроверг теорию теплорода, согласно которой теплота рассматривалась как особая жидкость, которая впитывалась телами в различной степени в зависимости от теплового состояния. Ломоносов также впервые ввел понятие абсолютного нуля. Он заявил, что должна существовать наивысшая степень холода, при которой отсутствует какое либо движение частиц, включая и вращательное. Непосредственным доказательством хаотичности теплового движения является броуновское движение.
Особенно стоит отметить труды русского ученого и мыслителя М.В. Ломоносова (1711-1765г.г.), который предпринял попытку дать единую картину всех известных в его время физических и химических явлений. При этом он исходил из корпускулярного (по современной терминологии – молекулярного) представления о строении материи. Восставая против господствовавшей в его время теории теплорода (гипотетической тепловой жидкости, содержание которой в теле определяет степень его нагретости), Ломоносов «причину тепла» видит в во вращательном движении частиц тела. Таким образом, Ломоносовым были по существу сформулированы молекулярно-кинетические представления. Также М.В. Ломоносов впервые объяснил природу теплоты на основе беспорядочного движения молекул. По его представлениям температура вещества не имеет ограничения сверху, т.к. скорости теплового движения молекул могут быть сколь угодно велики. При уменьшении скорости молекул до нуля должно быть достигнуто минимально возможное значение температуры вещества. Объяснение природы теплоты движением молекул и вывод о существовании температуры абсолютного нуля, сделанный Ломоносовым, получили теоретическое и экспериментальное подтверждение в конце 19в.
Представления о молекулярном строении тел Ломоносовым высказывались в следующей форме. Он писал: «Нельзя также отрицать движение тел там, где глаз его не видит; кто будет отрицать, что движутся листья и ветви деревьев при сильном ветре, хотя издали он не заметит никакого движения. Как здесь из-за отдаленности, так и в горячих телах вследствие малости частичек вещества движение скрывается от взоров». Т.е. причина того, что тела нам представляются сплошными в том, что атомы и молекулы чрезвычайно малы.
Как уже говорилось благодаря трудам многих ученых, начало которым положил Ломоносов, Атомистика во второй половине 19в. – начале 20в. превратилась в научную теорию.
Для характеристики масс атомов и молекул применяют величины, получившие название относительной атомной массы элемента (сокращенно – атомной массы) и относительной молекулярной массы вещества (сокращенно – молекулярной массы).
ОПРЕДЕЛЕНИЕ: Атомной массой (Ar) химического элемента называется отношение массы атома этого элемента к 1/12 массы атома С12.
ОПРЕДЕЛЕНИЕ: Молекулярной массой (Mr) вещества называется отношение массы молекулы этого вещества к 1/12 массы атома С12.
ОПРЕДЕЛЕНИЕ: Единица массы, равная 1/12 массы атома С12, называется атомной единицей массы (а.е.м.).
Тогда, масса атома, выраженная в кг, будет равна Ar×mед., а масса молекулы Mr×mед., где mед. – атомная единица массы, выраженная в кг.
ОПРЕДЕЛЕНИЕ: Количество вещества, в котором содержится число частиц (атомов или молекул), равное числу атомов в 0,012кг изотопа углерода С12, называется молем.
ОПРЕДЕЛЕНИЕ: Число частиц, содержащееся в моле (или в киломоле) вещества, называется числом Авогадро.
NA=6,023×1023моль-1=6,023×1026кмоль-1.
Итак, в 1 моле меди (Cu) содержится NA атомов Cu; в 1 моле азота содержится NA атомов азота и т.д.
Масса моля называется молярной массой М.
Молярная масса 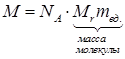 . (*)
. (*)
Для углерода С12: ‑ М=12кг/кмоль, масса атома рана 12·mед.. Тогда из (*) следует:
12кг/кмоль=NA(кмоль-1)×12×mед.(кг).
Отсюда
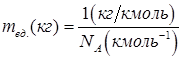 .
.
Зная число Авогадро, получаем: 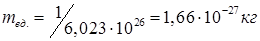 .
.
Таким образом, масса любого атома равна 1,66×10-27×Ar, (кг), а масса любой молекулы: 1,66×10-27×Mr, (кг).
Так как произведение NA×mед. численно рано “1”, то масса киломоля M численно рана относительной молекулярной массе Mr. (При этом Mr – безразмерная величина, [M] = [кг/кмоль]).
Или
ОПРЕДЕЛЕНИЕ: Количество вещества, масса которого, выраженная в кг, численно равна его молекулярному весу, называется кмолем.
Проведем теперь оценку размеров молекул.
Предположив, что в жидкостях молекулы располагаются достаточно близко друг к другу, приближенную оценку объема одной молекулы получим, разделив объем киломоля жидкости, например, воды на число молекул в киломоле NA. Киломоль (т.е., 18 кг) воды занимает объем 0,018м3. Следовательно, на долю одной молекулы приходится объем равный 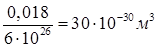 . Отсюда линейные размеры молекул воды приблизительно равны
. Отсюда линейные размеры молекул воды приблизительно равны 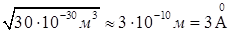 .
.
У молекул других веществ размеры молекул того же порядка.
2. Молекулы, образующие тело, находятся в состоянии непрерывного беспорядочного (хаотичного) движения.
При этом молекулы, сталкиваясь друг с другом, изменяют свою скорость как по величине, так и по направлению. Правда, столкновения в обычном смысле этого слова не происходит, т.к. соприкосновению молекул препятствуют резко возрастающие при сближении силы отталкивания. Однако действие этих сил приводит к такому же результату, как и обычное столкновение, т.е. к отскакиванию сблизившихся молекул друг от друга.
Скорость движения молекул в теле связана с его температурой, чем больше скорость, тем выше температура тела.
Непрерывное хаотическое движение молекул наглядно обнаруживается в явлениях диффузии и броуновского движения.
3. Между молекулами вещества одновременно действуют силы взаимного притяжения (сцепления) и силы взаимного отталкивания (иначе говоря, силы взаимодействия).
Согласно экспериментальным и теоретическим исследованиям межмолекулярные силы взаимодействия “f” обратно пропорциональны n-ой степени расстояния r между ними, т.е. 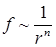 .
.
Для сил притяжения – n=7;
Для сил отталкивания – n=9…15.
Только при таком соотношении между fприт. и fотталк. молекулы могут находиться в устойчивом равновесии на некотором расстоянии друг от друга.
Примерный характер потенциальной энергии взаимодействия молекул в зависимости от расстояния между ними показан на рисунке. Равновесное расстояние r0 между молекулами составляет около 3×10-8см (на этом расстоянии F = 0). На расстоянии r ≥ 1,5×10‑7см межмолекулярные силы практически перестают действовать (F®0), т.е. силы межмолекулярного взаимодействия проявляются на расстояниях такого же порядка, что и размер самих молекул.
 (Силы межмолекулярного взаимодействия на больших расстояниях имеют электрическую природу, обусловленную тем, что молекулы состоят из электрически заряженных частиц и молекулы либо изначально полярны, в силу несимметричности расположения зарядов, либо, имея нулевой средний по времени дипольный момент, обладают ненулевым мгновенным дипольным моментом, в силу непрерывного движения составляющих их заряженных частиц).
(Силы межмолекулярного взаимодействия на больших расстояниях имеют электрическую природу, обусловленную тем, что молекулы состоят из электрически заряженных частиц и молекулы либо изначально полярны, в силу несимметричности расположения зарядов, либо, имея нулевой средний по времени дипольный момент, обладают ненулевым мгновенным дипольным моментом, в силу непрерывного движения составляющих их заряженных частиц).
--------- « » ---------
Для того чтобы исследовать структуру вещества и происходящие в нем процессы используют 2 (два) метода (подхода):
Молекулярно-кинетическая теория ставит целью истолковать те свойства тел, которые непосредственно наблюдаются на опыте, например давление, температуру и другие параметры, как суммарный результат действия молекул. Для этого она пользуется статистическим методом, т.е. вычисляет средние величины, которые характеризуют движение огромной совокупности частиц.
Другим методом изучения различных свойств вещества является термодинамический метод, который в отличие от статистического не интересуется микроскопической картиной. В основе термодинамического метода лежат несколько фундаментальных законов, установленных на основании огромного числа опытных фактов, например, законы сохранения и перехода энергии. В отличие от молекулярно-кинетической теории термодинамика изучает макроскопические свойства тел и явлений природы, не интересуясь их микроскопической картиной.
В основе термодинамики лежат несколько фундаментальных законов (называемых началами термодинамики), установленных на основании обобщения большой совокупности опытных данных. В силу этого выводы термодинамики имеют весьма общий характер.
1 начало – закон сохранения и превращения энергии в тепловых процессах.
2 начало – указывает направление протекания тепловых процессов.
3 начало – заключается в том, что абсолютный нуль температуры недостижим.
Термодинамический метод позволяет, не делая никаких предположений о молекулярном строении вещества, получить основные закономерности для тепловых процессов, установить связь между ними.
Статистический и термодинамический методы дополняют друг друга, образуя единое целое.
Для описания поведения термодинамических систем (газы, жидкости и т.д.) пользуются следующими величинами: давлением p , объемом V и абсолютной температурой T , которые называют термодинамическими параметрами. Первые два параметра достаточно хорошо известны, поэтому рассмотрим подробнее температуру.
Дата добавления: 2015-11-04; просмотров: 839;
