Внутренняя энергия реального газа.
В идеальном газе внутренняя энергия определяется только кинетической энергией хаотического движения его молекул. В реальных газах имеются силы взаимодействия и, следовательно, необходимо учитывать потенциальную энергию. Ввиду наличия теоремы о равнораспределении кинетической теории по степеням свободы она однозначно определяется температурой газа и зависит от объема.
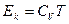 как было получено раньше.
как было получено раньше.
Если пользоваться по прежнему моделью твердых шаров, то необходимо учитывать только силы притяжения. 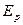 будет зависеть от среднего расстояния между частицами, то есть от объема. Работа по расширению газа, есть работа против внутренних сил притяжения, которые обуславливают внутреннее давление:
будет зависеть от среднего расстояния между частицами, то есть от объема. Работа по расширению газа, есть работа против внутренних сил притяжения, которые обуславливают внутреннее давление: 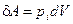 . Тогда
. Тогда
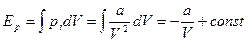 .
.
Без ограничения общности можно положить const=0, т.к. сама внутренняя энергия определена с точностью до аддитивной постоянной.
Тогда
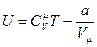 - для одного моля
- для одного моля
или
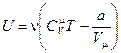 - для произвольной массы.
- для произвольной массы.
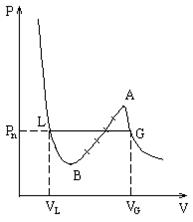 В прошлой лекции мы выяснили, что участок BA изотермы Ван-дер-Ваальса на практике не реализуется. То есть реальная изотерма должна распасться на две ветви. Естественно предположить, что ветви соответствуют различным фазовым состояниям вещества. При
В прошлой лекции мы выяснили, что участок BA изотермы Ван-дер-Ваальса на практике не реализуется. То есть реальная изотерма должна распасться на две ветви. Естественно предположить, что ветви соответствуют различным фазовым состояниям вещества. При 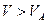 - это газ, при
- это газ, при 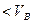 - это жидкость. Таким образом, уравнение Ван-дер-Ваальса распространяется на область жидкого состояния. Если сжимать достаточно разреженный газ вдоль изотермы, то естественно предположить, что можно достичь Точки A. Однако, как было впервые обнаружено Ван Марумом (Голландия) в конце 18 этого не происходит. При достижении точки G давление перестает расти и остается постоянным до точки L. При этом газ в точке G начинает конденсироваться, при движении вдоль GL система находится в двухфазном состоянии и в точке L весь газ переходит в жидкость и далее уже сжимается жидкость, чем и объясняется резкий рост давления.
- это жидкость. Таким образом, уравнение Ван-дер-Ваальса распространяется на область жидкого состояния. Если сжимать достаточно разреженный газ вдоль изотермы, то естественно предположить, что можно достичь Точки A. Однако, как было впервые обнаружено Ван Марумом (Голландия) в конце 18 этого не происходит. При достижении точки G давление перестает расти и остается постоянным до точки L. При этом газ в точке G начинает конденсироваться, при движении вдоль GL система находится в двухфазном состоянии и в точке L весь газ переходит в жидкость и далее уже сжимается жидкость, чем и объясняется резкий рост давления.
На прямой 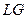 газ находится в равновесии со своей жидкостью. Такой газ называется насыщенным паром, его давление
газ находится в равновесии со своей жидкостью. Такой газ называется насыщенным паром, его давление  .
.
Участки 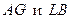 называются нестабильными состояниями. Рассмотрим их более подробно.
называются нестабильными состояниями. Рассмотрим их более подробно.
1. 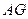 . Если пар очистить от всевозможных примесей пыли, ионов и т.д., то при достижении
. Если пар очистить от всевозможных примесей пыли, ионов и т.д., то при достижении 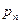 конденсация не начнется, т.к. будут отсутствовать центры конденсации. Т. е. пар можно сжать до давлений
конденсация не начнется, т.к. будут отсутствовать центры конденсации. Т. е. пар можно сжать до давлений 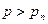 при данной температуре. Такое состояние называется пересыщенным паром. Достаточно попасть пылинке, произойдет резкая конденсация, система скачком вернется на равновесную прямую
при данной температуре. Такое состояние называется пересыщенным паром. Достаточно попасть пылинке, произойдет резкая конденсация, система скачком вернется на равновесную прямую 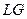 для двухфазной области.
для двухфазной области.
2. 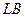 . Соответствует задержке образования паровой фазы при изотермическом расширении жидкости, то есть
. Соответствует задержке образования паровой фазы при изотермическом расширении жидкости, то есть 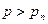 . Это состояние называется растянутой или перегретой жидкостью. Можно реализовать при отсутствии центра кипения, например пузырьков воздуха. Достаточно малейшего воздействия и жидкость вскипает, возвращаясь в равновесную прямую
. Это состояние называется растянутой или перегретой жидкостью. Можно реализовать при отсутствии центра кипения, например пузырьков воздуха. Достаточно малейшего воздействия и жидкость вскипает, возвращаясь в равновесную прямую 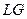 .
.
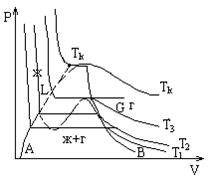 Рассмотрим семейство экспериментальных изотерм. С повышением температуры горизонтальный участок сокращается, стягиваясь в точку при
Рассмотрим семейство экспериментальных изотерм. С повышением температуры горизонтальный участок сокращается, стягиваясь в точку при 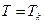 . Т. е. плотности жидкости и газа с повышением температуры сближаются и в критической точке совпадают. Т. е. в критической точке исчезает всякое различие между жидкостью и газом. В этом смысле говорят, что в критической точке переход вещества из газообразного в жидкое и наоборот, происходит непрерывно. Выше
. Т. е. плотности жидкости и газа с повышением температуры сближаются и в критической точке совпадают. Т. е. в критической точке исчезает всякое различие между жидкостью и газом. В этом смысле говорят, что в критической точке переход вещества из газообразного в жидкое и наоборот, происходит непрерывно. Выше  вещество не может находиться в жидком состоянии. Это было впервые отмечено Менделеевым, который назвал
вещество не может находиться в жидком состоянии. Это было впервые отмечено Менделеевым, который назвал  температурой абсолютного кипения. Таким образом состояние под кривой
температурой абсолютного кипения. Таким образом состояние под кривой 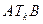 соответствует двухфазному состоянию, над кривой - однофазному, причем левее
соответствует двухфазному состоянию, над кривой - однофазному, причем левее 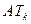 - жидкость, правее
- жидкость, правее 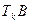 - газ. При переходе по горизонтали из L в G, расширяя вещество при неизменной температуре имеем испарение, при обратном переходе - конденсацию. Причем, путем сжатия газ можно перевести в жидкое со
- газ. При переходе по горизонтали из L в G, расширяя вещество при неизменной температуре имеем испарение, при обратном переходе - конденсацию. Причем, путем сжатия газ можно перевести в жидкое со  .стояние только в том случае, если его
.стояние только в том случае, если его  . При
. При 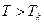 никаким сжатием этого сделать нельзя. Все эти результаты были получены в работах Томаса Эндрюса (Англия) в период с 1861 по 1869 год. Он установил, что сжатием газ можно превратить в жидкость только тогда, когда его температура ниже критической. Но это невозможно сделать никаким повышением давления, если его температура выше критической.
никаким сжатием этого сделать нельзя. Все эти результаты были получены в работах Томаса Эндрюса (Англия) в период с 1861 по 1869 год. Он установил, что сжатием газ можно превратить в жидкость только тогда, когда его температура ниже критической. Но это невозможно сделать никаким повышением давления, если его температура выше критической.
Дата добавления: 2015-10-26; просмотров: 1164;
