Рекомендации к изучению теоретического материала
При обсуждении свойств какого-либо элемента (Э) обычно поступают следующим образом.
Во-первых, определяют характер связи между его атомами в простом веществе. По этому признаку элементы делятся на металлы (металлическая связь) и неметаллы (ковалентная связь).
Во-вторых, выясняют отношение элемента к кислороду, т.е. возмож-ность реакции Э + n/2 O2 = ЭОn. В зависимости от природы элемента и степени его окисления образующийся оксид ЭОn может быть основным, кис-лотным, амфотерным или безразличным (несолеобразующим). Все эти свойства проявляются по отношению оксидов к воде, которая является совер-шенно особым оксидом в условиях Земли.
Взаимодействуя с водой непосредственно или косвенно, оксиды образуют гидроксиды, которые можно разделить на несколько типов по характеру их диссоциации в воде, а также по другим признакам.
Разумеется, свойства элемента Э не исчерпываются его взаимодей-ствием с кислородом, и на месте кислорода может стоять любой другой элемент, что приводит к образованию всех возможных бинарных соединений.
В современной химической номенклатуре бинарные соединения, принадлежащие одному классу, принято называть по тому элементу, который имеет большую электроотрицательность и, значит, отрицательную степень окисления, добавляя к его названию суффикс -ид: ЭОn – оксиды, ЭCl n- хлориды, Н nЭ – гидриды и т.д.
Если расположить элементы в ряд по возрастанию значений электро-отрицательности, то в левой его части окажутся щелочные и щелочнозе-мельные металлы, а закончится ряд наиболее электроотрицательным элемен-том – фтором. Электроотрицательность (см. приложение 3) меняется в преде-лах от 0,86 (Cs) до 4,10 (F). Элементы с минимальными значениями электро-отрицательности в соединениях с любыми другими элементами будут иметь положительные степени окисления. В водных растворах эти элементы существуют только в форме катионов. Чем больше электроотрицательность элемента, тем меньше число партнеров, в соединениях с которыми он может проявлять положительные степени окисления.
Высокоотрицательные элементы – элементы главных подгрупп Пери-одической системы – участвуют в образовании наименьшего числа классов бинарных соединений: фтор образует только фториды, кислород – оксиды, но соединения кислорода должны быть и в классе фторидов; соединения хлора помимо класса хлоридов должны быть в классах оксидов и фторидов.
Рассмотрение свойств химических элементов на основании периоди-ческого закона с позиций электроотрицательности элементов обычно начи-нают с р-элементов VII группы, в которой расположен наиболее электро-отрицательный элемент – фтор.
9.2 Неметаллы
Галогены – типичные неметаллы, атомы которых на внешнем слое име-ют семь электронов, расположенных на s- и p-подуровнях. Электронная кон-фигурация атомов галогенов описывается общей формулой ns2np5nd0 (ис-ключение составляет фтор – 2s22p5). Атомы галогенов легко присоединяют один электрон, проявляя окислительные свойства и типичную для них сте-пень окисления -1.
Следует обратить внимание на тот факт, что свойства фтора отлича-ются от свойств остальных галогенов. Это обусловлено различием в элект-ронных структурах атомов галогенов. Атомы хлора, брома, йода в отличие от фтора имеют незаполненные d-орбитали, на которых могут размещаться ва-лентные электроны. Поэтому для них характерны положительные степени окисления (+1, +3, +5, +7), а для фтора – только -1.
Галогены как окислители активно вступают в химические реакции с большинством элементов, но не соединяются непосредственно с кислородом и азотом. При проведении опытов следует помнить, что окислительная активность галогенов возрастает с уменьшением радиуса атома.
Водородные соединения галогенов – это бесцветные газообразные вещества, водные растворы которых представляют собой соответствующие кислоты. HI – самая сильная кислота в ряду галогеноводородных кислот. Отрицательные ионы галогенов являются восстановителями и могут быть окислены различными окислителями, например, 2Br- - 2 ē = Br2. Восстано-вительная активность ионов галогенов от Cl- к I- возрастает с увеличением радиусов, а устойчивость соединений уменьшается. Так как серная кислота является сильным окислителем, а HBr и HI – наиболее сильными восстановителями из галогеноводородов, то последние в момент образования могут окисляться серной кислотой, при этом получаются свободные галогены: 8HI + H2SO4 = 4I2 + H2S + 4H2O.
Для галогенов характерны кислородные соединения разной устой-чивости, в которых они проявляют положительные степени окисления от +1 до +7. Например, кислородные кислоты хлора: HClO, HClO2, HClO3 и HClO4. Сила этих кислот возрастает с увеличением степени окисления, а окисли-тельные свойства в этом направлении уменьшаются.
Кислород и сера. К р-элементам VI группы относятся типические элементы – кислород О, сера S и элементы подгруппы селена – селен Se, теллур Те, полоний Ро. Электронная конфигурация атомов халькогенов описывается общей формулой ns2np4nd0 (исключение составляет кислород – 2s22p4). В ряду
О - S - Se - Те - Ро уменьшаются энергии ионизации, увеличиваются размеры атомов и ионов. Это ослабляет неметаллические признаки элементов, а усиливает металлические: кислород – элемент-неметалл, полоний – элемент-металл. Окислительные свойства в ряду уменьшаются, а восстановительные – увеличиваются. У этих элементов возможны степени окисления от -2 до +6, причём с повышением заряда ядра более характерными становятся меньшие положительные.
Первый элемент этой группы – кислород – самый распространённый элемент на Земле. Подобно фтору, кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). Поскольку по электро-отрицательности кислород уступает только фтору, степень окисления кис-лорода в большинстве соединений равна -2. Кроме того, кислород проявляет степени окисления +2 и +4, +1 и –1.
Наиболее устойчива двухатомная молекула кислорода О2. Кислород при нагревании и в присутствии катализатора проявляет высокую химичес-кую активность. С большинством простых веществ он взаимодействует не-посредственно, образуя оксиды (соединения кислорода в степени окисления –2), и лишь по отношению к фтору проявляет восстановительные свойства. Важнейшим из оксидов является оксид водорода – Н2О. Вода составляет 50-99% массы любого живого существа, кровь человека содержит более 4/5 воды, мускулы – 35 % воды. При средней продолжительности жизни (70 лет) человек выпивает около 25 т воды.
Аллотропную модификацию кислорода – озон О3 можно рассматри-вать как соединение О(+4) – ОО2. В естественных условиях озон образуется
из атмосферного кислорода при грозовых разрядах, а на высоте 10-30 км – под действием ультрафиолетовых лучей. Озон задерживает вредное для жиз-ни ультрафиолетовое излучение Солнца и поглощает инфракрасное излу-чение Земли, препятствуя её охлаждению.
Если к молекуле О2 присоединить один или два электрона, то обра-зуется надпероксид-ион или пероксид-ион соответственно, которые входят в состав перекисных соединений, называемых супероксидами и пероксидами. Пероксид водорода относится к слабым кислотам: Н2О2 = Н+ + НО2-.
Сера. При химическом взаимодействии с другими элементами сера проявляет степени окисления –2, +4 и +6. Среди этих соединений в первую очередь следует рассмотреть сульфиды – бинарные соединения, содержащие серу в степени окисления –2. Как и оксиды, они подразделяются на основ-ные, кислотные, амфотерные и нейтральные (как несолеобразующие окси-ды). Сульфид водорода – Н2S – является типичным представителем кислот-ных сульфидов, водный раствор которого называется сероводородной кисло-той и имеет слабокислую реакцию Н2S = H+ + HS-, HS- = H+ + S2-. Боль-шинство сульфидов – сильные восстановители, что существенно отличает их свойства от свойств оксидов
2Н2S + H2SO3 = 3S +3H2O.
Н2S + 4Br2 +4H2O = H2SO4 + 8HBr
3CuS + 14HNO3 = 3Cu(NO3)2 + 3H2SO4 + 8NO + 4H2O.
Ион S2- может координировать вокруг себя от 1 до 8 нейтральных атомов серы, образуя комплексы – полисульфиды Na2S + 2S = Na2[S3].
В степенях окисления +4 и +6 сера образует оксиды – диоксид серы SO2 и триоксид серы SO3, являющиеся по своему характеру кислотными. Cжигая серу на воздухе или в кислороде, можно получить диоксид серы SO2, водный раствор которого представляет собой сернистую кислоту, диссоциирующую по схеме
SO2 + H2O = H2SO3 ⇄ Н+ + HSO3- ⇄ 2Н+ + SO32-.
H2SO3 – кислота средней силы, образует два типа солей: сульфиты и гидросульфиты. Сернистая кислота и её соли в химических реакциях про-являют как окислительные, так и восстановительные свойства.
Оксид SO3 – ангидрид серной кислоты. Серная кислота H2SO4 – силь-ная двухосновная кислота, образующая средние и кислые сульфаты
H2SO4 ⇄ Н+ + HSO4- ⇄ 2Н+ + SO42
Следует различать концентрированную и разбавленную кислоту. В разбавленной серной кислоте окислителем является ион Н+
Zn + H2SO4 = ZnSO4 + H2.
В концентрированной серной кислоте окислителем является сера кислотного остатка, которая может восстанавливаться по одной из схем:
SO42- + 4H+ + 2ē = SO2 + 2H2O;
SO42- + 8H+ + 6ē = S + 4H2O;
SO42- + 10H+ + 8ē = H2S + 4H2O.
Азот и фосфор. Главную подгруппу пятой группы составляют элемен-ты: азот, фосфор, мышьяк, сурьма и висмут. Азот и фосфор – неметаллы, сурьма и висмут – металлы, а мышьяк – металлоид. Исходя из общей элект-ронной конфигурации ns2np3nd0 (у азота 2s22p3), можно ожидать изменение степеней окисления от –3 до +5, причём к более устойчивым следует отнести нечётные степени окисления. А наиболее характерными являются –3, +3 и +5. От азота к висмуту размеры атомов и ионов увеличиваются, а энергии ионизации уменьшаются. Таким образом, в группе хорошо прослеживается общая тенденция к повышению основной и восстановительной активности и понижению кислотной и окислительной в ряду N – Bi, а также к концу груп-пы характерность низшей положительной степени окисления. Следует обра-тить внимание на то, что все элементы не вытесняют водород из кислот и воды независимо от кислотности среды, а, следовательно, относятся к неак-тивным восстановителям.
В двухатомной молекуле азота атомы связаны тройной связью, что обусловливает инертность молекулярного азота при низких температурах. При повышенной температуре азот взаимодействует с металлами, водоро-дом, галогенами и серой, образуя нитриды – соединения, содержащие азот в степени окисления –3. В соединениях с кислородом и фтором азот имеет степень окисления +3 (наиболее часто) и +5.
Фосфор имеет несколько аллотропных модификаций (чёрный, белый и красный). Окислительная активность фосфора несколько ниже, чем у азота. В отличие от последнего, фосфор непосредственно не реагирует с водородом. Проявляя восстановительные свойства, фосфор чаще всего окисляется до степени окисления +5:
P4 + 5O2 = P4O10,
3P4 + 20HNO3 + 8H2O = 12H3PO4 + 2NO,
P4 + 3KOH + 3H2O = PH3 + 3KH2PO4.
К водородным соединениям азота относятся: аммиак (NН3), гидразин (N2Н4) и гидроксиламин (NН2ОН). Водные растворы этих соединений имеют щелочную реакцию благодаря наличию у атома азота неподеленной пары электронов.
NН3 + Н2О = NН4+ + ОН- К = 1,8.10-5;
N2Н4 + Н2О = N2Н5+ + ОН- К = 8,5.10-7;
NН2ОН + Н2О = NН3ОН+ + ОН- К = 2,0.10-8.
Они являются слабыми основаниями и, проявляя основные свойства, взаимо-действуют с кислотами и кислотными оксидами, образуя соли аммония, гид-разония и гидроксиламмония. Нагревая аммонийные соли, следует обратить внимание на зависимость продуктов разложения от окислительной актив-ности аниона. Если анион окислитель, то образуется азот или оксид азота (І), если нет, то выделяется аммиак. Аммиак и гидразин проявляют, особенно последний, восстановительные свойства, окисляясь до азота
2NH3 + 3Cl2 = N2 + 6HCl;
4KMnO4 + 5N2H4 + 6H2SO4 = 5N2 + 4MnSO4 + 2K2SO4 + 16H2O.
Гидроксиламин в щелочной среде сильный восстановитель, а в кислой – окислитель средней силы
2NH2OH + I2 + 2KOH = N2 + 2KI + 4H2O;
2NH2OH + 4FeSO4 + 3H2SO4 = 2Fe2(SO4)3 + (NH4)2SO4 + 2H2O.
Свойства водородных соединений фосфора отличаются от свойств водородных соединений азота. Например, фосфин в отличие от аммиака в водном растворе показывает нейтральную реакцию. Электродонорные свой-ства фосфина проявляются только в реакциях с наиболее сильными кислотами РН3 + НI = РН4I. Фосфин и соли фосфина – сильные восстановители в любых средах.
Изучая свойства оксидов N2O, NO, N2O3, NO2 и N2O5, надо учесть, что первые два относятся к несолеобразующим, а остальные - к кислотным. Оксид азота (III) является ангидридом азотистой кислоты, оксид азота (V) – азотной кислоты, а оксид азота (IV) – смешанным ангидридом азотистой и азотной кислот. Проявляя кислотные свойства, эти оксиды взаимодействуют с основными оксидами и щелочами с образованием нитритов и нитратов. Оксид азота (III) проявляет окислительную и восстановительную активность, тогда как оксиды азота (IV) и (V) – только окислительную. Несолеобразующий оксид N2O при нагревании разлагается с выделением атомарного кислорода и является сильным окислителем: N2O → N2 + О.
Азотная кислота (НNО3) – одна из самых сильных кислот. Она относится к сильным окислителям и реагирует почти со всеми металлами и многими неметаллами. В азотной кислоте не растворяются золото, платина, иридий и родий, а чистые железо, алюминий и хром в концентрированной кислоте на холоде «пассивируются». В реакции с металлами азот в азотной кислоте может восстановиться до различной степени окисления. Последняя зависит от концентрации кислоты и активности металла:
 НNО3
НNО3
NO2 NO N2O (N2) NН4NО3
активные Ме неактивные Ме активные Ме с активные Ме с раз-
с концентриро- с разбавленной концентрирован- бавленной кислотой,
ванной кислотой, кислотой, ной кислотой Ме средней актив-
большинство Ме средней ак- ности с очень раз-
неметаллов тивности с кон- бавленной кислотой
центрированной
кислотой
Соли азотной кислоты (нитраты) хорошо растворимы в воде. При нагревании они разлагаются. Состав продуктов разложения зависит от положения металлов в ряду стандартных электродных потенциалов:
 до Mg MeNO2 + O2
до Mg MeNO2 + O2
Me(NO3)n
Mg – Cu MeO + NO2 + O2
после Сu Me + NO2 + O2
Азотистая кислота (HNO2) относится к слабым кислотам (Кд= 5,1.10-4). Так же, как и оксид азота (III), азотистая кислота и нитриты в реакциях выступают в качестве окислителей и восстановителей.
Оксиды фосфора Р4О6 и Р4О10 относятся к кислотным и являются ангидридами фосфористой и фосфорной кислот
Р4О6 + 6Н2О = 4Н3РО3; Р4О10 + 6Н2О = 4Н3РО4.
Ортофосфорная кислота (Н3РО4) является трёхосновной кислотой средней силы. Она образует три типа солей: ортофосфаты, гидрофосфаты и дигид-рофосфаты. В реакциях окисления-восстановления активности не проявляет. Н3РО4 = Н+ + Н2РО4- К1 = 7,6.10-3;
Н2РО4- = Н+ + НРО42- К2 = 6,2.10-8;
НРО42- = Н+ + РО43- К3 = 4,2.10-13.
Фосфористая кислота (Н3РО3) – двухосновная кислота средней силы, образующая два типа солей: фосфиты и гидрофосфиты. Фосфористая кислота (так же, как оксид фосфора (III)) проявляет восстановительные свойства, причём фосфор окисляется до степени окисления +5.
Н(Н2РО3) = Н+ + Н(НРО3)- К1 = 1,6.10-2;
Н(НРО3)- = Н+ + (НРО3)2- К2 = 2.10-7.
Фосфорноватистая кислота (Н3РО2) – одноосновная кислота средней силы, образует при реакции со щелочами гипофосфиты.
Н(Н2РО2) = Н+ + (Н2РО2)- К = 5,9.10-2.
Она не имеет ангидрида. Сама кислота и её соли являются сильными восста-новителями. В ряду Н3РО4 - Н3РО3 - Н3РО2 возрастает сила кислоты и её восстановительная способность.
Углерод и кремний. Главную подгруппу IV группы составляют углерод и кремний – неметаллы, германий, олово и свинец – металлы. Валентная электронная конфигурация атомов ns2np2nd0 (исключение - углерод 2s22p2) свидетельствует о том, что характерными степенями окисления будут чётные -4, -2, +2, +4. Обратите внимание, что у углерода число валентных элект-ронов и орбиталей совпадает, так же, как и у водорода. Это одна из причин повышенной устойчивости цепей из атомов углерода, являющихся основой органических соединений.
В пределах подгруппы возрастает склонность к низшим положительным степеням окисления элемента и высшим его гибридизациям, соответствующим координационным числам 4 и 6. В пределах подгруппы кислотные свойства убывают, а основные возрастают, а также возрастают восстановительные свойства. Элементы IV группы не растворяются в воде, но растворяются в кислотах – азотной, смеси азотной и плавиковой кислот, серной кислоте (свинец), образуя соответствующие кислоты (в высших сте-пенях окисления) и соли (в низших степенях окисления); а также в щелочах (кроме углерода), образуя комплексные гидроксосоли.
Углерод образует три гомосоединения (аллотропные модификации), отличающихся гибридизацией атомов: алмаз (sp3), графит (sp2) и карбин (sp), среди которых к простому веществу относят графит. Графит – наиболее реакционноспособная модификация углерода, образующая соединения вклю-чения – графитиды (КС8, CF и др.), сохраняющие макромолекулярные слои графита С2∞. При обычной температуре углерод инертен, однако при нагревании реагирует практически со всеми металлами. У кремния наиболее устойчива модификация типа алмаз (sp3 гибридизация), поэтому он также инертен при обычных условиях.
Соединения углерода
Большую группу соединений углерода составляют карбиды. Среди кислородных соединений в первую очередь следует рассмотреть оксиды СО – монооксид и СО2 – диоксид. Первый из них имеет в молекуле тройную связь С≡О ( d=0,113 нм, tпл= - 205 оС; tкип= - 191 оС) и поэтому достаточно инертен. Он не вступает в реакции взаимодействия с водой и кислотами, однако не может быть отнесен к безразличным оксидам, так как реакция со щелочами приводит к образованию солей муравьиной кислоты – формиатов
СО + NaOH = NaCOOH.
В реакциях ОВР монооксид является сильным восстановителем
Fe2O3 + 3CO = 2Fe + 3CO2,
что используется в металлургической промышленности. Интересными явля-ются реакции взаимодействия с металлами, приводящие к образованию кар-бонилов: Cr + 6CO = Cr(CO)6. Разложение карбонилов используют для получения особо чистых металлов.
В диоксиде углерод находится в sp-гибридном состоянии, поэтому его молекула линейна О=С=О (d=0,116 нм, tпл = -78 оС). В реакциях он ведет себя как кислотный оксид
2CO2 + Ca(OH)2 = Ca(HCO3)2; Ca(OH)2 + CO2 = CaCO3↓ + H2O;
MgO + CO2 = MgCO3; BaCl2 + H2O + CO2 = BaCO3↓ + 2HCl;
CO2 + H2O = BaCO3.
Имеются немногочисленные реакции, в которых СО2 выступает в качестве окислителя СО2 + С = 2СО; 2СО2 + 5Mg = MgC2 + 4MgO.
Обычно оба оксида в лаборатории получают разложением кислот
HCOOH = H2O + CO; H2CO3 = H2O + CO2; H2C2O4 = H2O + CO2 + CO.
В промышленности их получают сжиганием угля или разложением карбо-натов
2C + O2 = 2CO; C + O2 = CO2; CaCO3 = CaO + CO2.
Диоксид является ангидридом кислоты Н2СО3, которая называется угольной. Она относится к малоустойчивым двухосновным кислотам, поэ-тому при растворении СО2 в воде существуют равновесия
H2O + CO2 = CO2 .H2O = Н2СО3 = Н+ + НСО3- = 2Н+ + СО32-.
Соли этой кислоты называются гидрокарбонатами и карбонатами и образу-ются в реакциях угольной кислоты со щелочами, амфотерными основаниями, основными оксидами и солями. Практически все гидрокарбонаты хорошо растворимы в воде, а из карбонатов к растворимым относятся только соли щелочных металлов и аммония. Угольную кислоту обычно получают либо растворением углекислого газа в воде, либо разложением карбонатов более сильными кислотами. Угольная кислота и её соли инертны в реакциях ОВР.
Соединения кремния
В соединениях кремний, в отличие от углерода, всегда находится в sp3- или sp3d2-гибридном состоянии. Поэтому кислородные соединения обычно полимерны и построены из тетраэдров SiO4, связанных вершинами и редко рёбрами. Диоксид кремния является типичным примером такого соединения. Благодаря этому он тугоплавок, очень твёрд и химически стоек. В его струк-туре тетраэдры связаны между собой всеми вершинами. В кислотно-основ-ных реакциях он ведёт себя как кислотный оксид, однако не взаимо-действует с водой, но может реагировать с плавиковой кислотой
SiO2 + 6HF = H2[SiF6] + 2H2O,
SiO2 + 2NaOH = Na2SiO3 + H2O,
2SiO2 + 3CaO = Ca3Si2O7.
В ограниченном количестве реакций ОВР оксид выступает в качестве окислителя, кроме реакций со фтором
SiO2 + 2Mg = Mg2Si + 2MgO, SiO2 + 2F2 = SiF4 + O2.
Кремниевые кислоты могут быть получены только косвенным путём, так как оксид кремния (IV) не взаимодействует с водой. Ортокремниевая кислота H4SiO4 существует только в растворе и относится к очень слабым кислотам. При стоянии в растворах происходит полимеризация кислоты с образованием объёмистого осадка метакремниевой кислоты (H2SiO3)x. Более точно состав последней выражается формулой mSiO2.nH2O, поэтому говорить о точном стехиометрическом составе осадка невозможно. Соли кремниевых кислот (силикаты) удобно получать при спекании оксида кремния или метакремниевой кислоты с оксидами, основаниями, амфотерными гидроксидами, карбонатами. За исключением ортосиликатов, анионы солей полимерны.
Следует обратить внимание на своеобразие гидролиза метасиликатов, протекающего по уравнению 2SiO32- + Н2О = Si2O52- + 2ОН-. Наряду с прос-тыми силикатами кремний образует большое количество сложных, в состав которых могут входить другие элементы, в первую очередь алюминий – алю-мосиликаты. Эти соединения составляют значительную часть земной коры. Очень интересные общеизвестные свойства имеют стёкла, которые можно получить, например, по реакциям
Na2CO3 + CaCO3 + 6SiO2 = Na2O.CaO.6SiO2 + 2CO2;
Na2SO4 + C + CaCO3 + 6SiO2 = Na2O.CaO.6SiO2 + CO + CO2 + SO2.
Бор. Главную подгруппу третьей группы составляют элементы: бор, алюминий, галий, индий и таллий. Бор – неметалл, алюминий, галлий, индий и таллий – металлы. Исходя из общей электронной конфигурации ns2np1nd0 (у бора 2s22p1) и значений электроотрицательностей элементов этой группы, можно ожидать изменение степеней окисления от 0 до +3, причём к более устойчивым следует отнести нечётные степени окисления. От бора к таллию размеры атомов и ионов увеличиваются, а энергия ионизации уменьшается. Таким образом, прослеживается общая тенденция к повышению основной и восстановительной активности и понижению кислотной и окислительной в ряду В – Tl, а также к концу группы характерность низшей положительной степени окисления (у таллия +1).
Для бора наиболее характерны соединения, в которых его степень окисления равна +3. Отрицательные степени окисления бора проявляются редко, с металлами бор обычно образует нестехиометрические соединения (М4В, М2В, МВ, М3В4 и др.). В обычных условиях бор весьма инертен и непосредственно взаимодействует только со фтором, а при нагревании окисляется кислородом, серой, хлором и даже азотом (в результате образуются ВF3, В2О3, В2S3, ВСl3, ВN). С водородом бор не взаимодействует. При сильном нагревании восстановительная активность бора проявляется в отношении таких устойчивых оксидов, как SiО2, Р2О5 и др. На бор действуют только горячие концентрированные азотная и серная кислоты, а также «цар-ская водка», переводя его в Н3ВО3. Щёлочи при отсутствии окислителей на бор не действуют. Бинарные соединения бора (III) кислотные. Об этом сви-детельствует характер их гидролиза и взаимодействия с основными соедине-ниями, например:
BCl3 + 3H2O = H3BO3 + 3HCl,
BCl3 + 6NH3 = B(NH2)3 + 3NH4Cl.
Бор с водородом образует многочисленные бораны ВхНу, простейший из них – диборан В2Н6. Бороводороды химически весьма активны: на воздухе самовоспламеняются и сгорают, разлагаются водой, спиртами и щелочами. Большинство имеют неприятный запах и очень ядовиты!
Бинарные соединения бора, будучи кислотными, при взаимодействии с основными соединениями образуют анионные комплексы, например:
2KOH + B2O3 = 2KBO2 + H2O,
2LiH + (BH3)2 = 2Li[BH4],
NaH + BF3 = Na[BF3H].
Оксоборат водорода (ортоборная кислота – Н3ВО3) – сравнительно мало растворим в воде, кислота – слабая, одноосновная. В отличие от обыч-ных кислот её кислотные свойства обязаны не отщеплению протона, а присо-единению ОН--ионов: В(ОН)3 + Н2О = [В(ОН)4]- + Н+. При нагревании ортоборат водорода теряет воду, переходя в полимерные метабораты водо-рода НВО2, а затем – в В2О3. Большинство оксоборатов металлов – полимер-ные соединения, содержащие в составе полиметаборатные анионы (ВО2-)n. Более других используется тетраборат натрия Nа2В4О7.10Н2О.
Контрольные вопросы
1. Как расположены неметаллы в Периодической системе? Как меняют-ся их свойства в периодах и группах?
2. Напишите электронные формулы для атомов галогенов, серы, азота, фосфора, углерода и бора. Укажите степени окисления, характерные для них в соединениях.
3. Приведите примеры реакций получения неметаллов.
4. Какими физическими свойствами обладают неметаллы, каково строение молекул галогенов, халькогенов и т.д.?
5. Какими химическими свойствами обладают неметаллы? Приведите примеры реакций.
6. Исходя из величин электроотрицательности, укажите, как в приве-денном ряду F, Cl, Br, I изменяется способность атомов принимать элек-троны? Напишите электронные формулы этих элементов.
7. Приведите формулы высших оксидов и гидроксидов (кислот), отве-чающих элементам с ns2np5 валентными электронами. Как меняется сила кис-лот HЭ в ряду этих элементов?
8. Объясните механизм образования водородной связи в молекуле HF.
9. Напишите электронные формулы Р и Ві. Определите квантовые чис-ла всех валентных электронов атома фосфора. Определите суммарный спин ns2np3 электронов и объясните характерные степени окисления у р-элементов V группы.
10. Приведите общую электронную формулу валентных орбиталей р-элементов III группы. Укажите изменение электроотрицательности в этой группе.
11. Приведите формулы высших оксидов и гидроксидов (кислот), кото-рые отвечают элементам с ns2np1 валентными электронами. Как меняются свойства гидроксидов в группе этих элементов?
12. Как изменяются кислотные и окислительные свойства кислород-содержащих кислот хлора в ряду: HClO, HClO2, HClO3, HClO4? Дайте объяс-нение. Чем объясняется, что растворимость йода в воде увеличивается в при-сутствии KJ?
13. Назовите соединения серы, которые в химических реакциях явля-ются: а) только восстановителями; б) только окислителями; в) восстановите-лями и окислителями. Напишите уравнения реакций.
14. Напишите структурную формулу серной кислоты. Укажите харак-тер химических связей, тип гибридизации, координационное число серы в анионе.
15. Почему синтез аммиака NH3 + 3H2 «2NH3 + Q проводят при повы-шенном давлении и температуре?
16. Составьте уравнения реакций получения азотной кислоты из азота воздуха.
17. Объясните причину различия в основности ортофосфорной, фос-фористой и фосфорноватистой кислот.
9.3 Общая характеристика металлов
Периодическая система элементов включает в себя только 22 неметал-ла, а все остальные элементы – металлы. К ним относятся s- и d-элементы (кроме водорода и гелия) и некоторые р-элементы (Al, Ga, In, Tl, Ge, Sn, Pb, Sb, Bi, Po). Следует обратить внимание на то, что большинство из металлов содержит на внешней электронной оболочке небольшое количество элек-тронов, поэтому характеризуется относительно малыми значениями потен-циалов ионизации. В связи с этим для металлов, в отличие от неметаллов, ха-рактерно образование катионов и катионных комплексов в низших степенях окисления (1÷4). В высших степенях окисления (5÷8) металлы проявляют кислотные свойства и образуют анионы и анионные комплексы. Таким обра-зом, металлы в большинстве случаев могут проявлять как основные, так и кислотные свойства, то есть относиться к амфотерным простым веществам. Среди всех металлов лишь s-элементы, кроме бериллия, проявляют только основные свойства и называются типическими, а все остальные металлы – амфотерные.
Низкие значения потенциалов ионизации и нулевое или отрицательное значение сродства к электрону определяют положительные степени окисле-ния металлов в соединениях. В связи с этим металлы в свободном состоянии являются восстановителями. Для реакции в водных растворах восстанови-тельная активность металла определяется величиной его стандартного элект-родного потенциала (Е0), положением в ряду напряжений металлов, состав-ленного исходя из общего уравнения Меп+ + пē → Ме. Наименьшее значение электродного потенциала (-3,045 в) у лития, а наибольшее (+1,692 в) – у зо-лота, нулевое значение – у водорода.
В зависимости от положения в ряду напряжения можно выделить три группы металлов: 1) с Е0 < - 2,3 в; 2) с - 2,3 в < Е0 < 0; 3) с Е0 > 0. Металлы 1-й группы при обычных условиях реагируют с водой и кислотами, вытесняя из них водород. Они легко окисляются неметаллами и плохо восстанавливаются из соединений. Металлы 2-й группы могут вытеснять водород из воды и ще-лочей при нагревании, а из кислот – при обычных условиях, если - 2,3 в < Е0 < - 0,25 в. Если - 0,25 в < Е0 < 0 в, то они с водой и щелочами не реагируют, а водород из кислот вытесняют при нагревании. Эти металлы относительно легко окисляются большинством неметаллов при нагревании и сравнительно легко могут быть получены восстановлением соединений. Металлы 3-й группы (Е0 > 0) водород из соединений не вытесняют, относительно плохо окисляются при нагревании, но легко восстанавливаются из соединений. Для растворения этих металлов используют кислородсодержащие кислоты-окислители, такие, как НNО3 и Н2SО4 (концентрированная), а в ряде случаев – очень сильные окислители – «царская водка»; соляная кислота, насыщенная хлором; селеновая кислота.
Все металлы, проявляющие амфотерные свойства, независимо от их положения в ряду напряжения, могут растворяться в щелочной среде в присутствии окислителей с образованием анионных комплексов.
Типические металлы, к которым относятся щелочные и щелочнозе-мельные элементы, проявляют только основные свойства и являются силь-ными восстановителями, окисляясь до степени окисления +1 (щелочные металлы) и +2 (щелочноземельные металлы и Мg):
Mg + H2SO4 (разб.) = MgSO4 + H2;
2Na + H2O = 2NaOH + H2; Mg + H2O = не реагирует;
5Ca + 12HNO3 (разб.) = 5Са(NO3)2 + N2 + 6H2O;
4Mg + 5H2SO4 (конц.) = 4MgSO + H2S + 4H2O.
Со щелочами эти металлы не взаимодействуют, так как не проявляют кислотных свойств. При окислении на воздухе образуются Li2O; Na2O2; K(Rb,Cs)O2; ЭО (Э – щелочноземельный металл). При нагревании металлов с азотом, серой, галогенами и фосфором образуются нитриды, сульфиды, гало-гениды и фосфиды соответственно.
Оксиды типических металлов проявляют только основные свойства. Они легко взаимодействуют с водой с образованием щелочей (ЭОН и Э(ОН)2), с кислотными оксидами и кислотами с образованием солей. Полу-чение металлов из оксидов крайне затруднено. Так, при восстановлении оксида натрия водородом образуется гидрид натрия.
Na2O + H2 = NaOH + NaH.
А для восстановления можно использовать металлы, стоящие в ряду напряжения левее получаемого металла.
Гидроксиды типических металлов (щёлочи) относятся к хорошо раст-воримым сильным электролитам, диссоциирующим в растворе практически полностью. Они легко взаимодействуют с кислотными оксидами и кислотами с образованием солей.
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O;
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O;
Ba(OH)2 + SiO2 = BaSiO3 + H2O;
NaOH + CO2 = NaHCO3; 2NaOH + CO2 = Na2CO3 + H2O.
В щелочах растворяются амфотерные металлы, а большинство неме-таллов диспропорционируют.
NaOH + Be + 2H2O = Na2[Be(OH)4] + H2;
2S + 6NaOH = Na2SO3 + 3Na2S + 3H2O.
При действии щелочей на соли образуются малорастворимые или пло-хо диссоциирующие основания.
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl;
(NH4)2CO3 + 2KOH = K2CO3 + 2NH3.H2O.
Основные свойства как простых веществ, так и их соединений возрас-тают в рядах Li – Fr, Mg – Ra.
Среди амфотерных металлов в первую очередь следует различать ме-таллы, стоящие в ряду напряжения до и после водорода, что определяет их восстановительную активность и условия растворения в кислотах и щелочах.
Be + 2H2O = Be(OH)2 + H2;
Fe + 2HCl = FeCl2 + H2;
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2; до водорода;
Ag + 2HNO3 (конц.) = AgNO3 + NO2 + H2O;
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O;
Pt + 2NaOH + 2NaNO3 = Na2PtO3 + 2NaNO2 + H2O; после водорода.
Для большинства амфотерных металлов характерны несколько степе-ней окисления, причём в низших степенях окисления проявляются основные свойства, в высших – кислотные, а в промежуточных – амфотерные. Низшие степени окисления стабилизируются в кислой среде, а высшие – в щелочной:
Cr + 2HCl = CrCl2 + H2;
Cr + 3NaClO + 2NaOH = Na2CrO4 + 3NaCl + H2O.
Низшие оксиды и гидроксиды этих металлов, проявляя основные свой-ства, взаимодействуют с кислотными оксидами и кислотами, а высшие окси-ды и гидроксиды (кислоты) – с основными оксидами и щелочами. Оксиды и гидроксиды в промежуточных степенях окисления имеют ярко выраженную амфотерность:
Cr2O3 + 2NaOH = 2NaCrO2 + H2O;
Cr2O3 + 6HNO3 = 2Cr(NO3)3 + 3H2O.
Большинство соединений, содержащих амфотерные металлы в высшей степени окисления, являются сильными окислителями (KMnO4; K2Cr2O7; NaBiO3; PbO2 и др.). У р-элементов в этом случае наибольшая активность наблюдается для металлов шестого периода, а у d-элементов – для металлов четвёртого периода.
Таким образом, в главных подгруппах сверху вниз возрастает склон-ность к низшим степеням окисления, а, значит, усиливаются основные и вос-становительные свойства. В побочных подгруппах стабилизируется высшая степень окисления, а, значит, возрастают кислотные свойства и ослабевает восстановительная активность.
Общие способы получения металлов
1. Реакциями восстановления из оксидов и солей:
Fe2O3 + 3CO = 2Fe + 3CO2;
3NiO + 2Al = Al2O3 + 3Ni;
CuO + H2 = Cu + H2O;
CuSO4 + Fe = Cu + FeSO4.
2. Реакциями разложения различных соединений:
TiI4 = Ti + 2I2;
Cr(CO)6 = Cr + 6CO;
BaO2 = Ba + O2.
Контрольные вопросы
1. Как расположены металлы в Периодической системе? Как меняются их свойства в периодах и группах?
2. Напишите электронные формулы для атомов натрия, кальция, хрома, свинца, железа. Укажите степени окисления, характерные для них в соеди-нениях.
3. Приведите примеры реакций получения металлов.
4. Как меняется потенциал ионизации и сродство к электрону в ряду s-элементов I группы, р-элементов III группы?
5. Какими химическими свойствами обладают металлы? Приведите примеры реакций.
6. Какие состояния окисления играют более важную роль у амфотер-ных металлов одной группы с увеличением порядкового номера?
7. Составьте уравнения реакций получения NaOH из Na2CO3 и NaCl.
8. Какую реакцию на лакмус и почему имеют растворы солей: KNO3, K3PO4, AgNO3, CuSO4, NaHS?
9. Осуществите следующие превращения: нитрат кадмия – оксид кадмия - кадмий – хлорид кадмия – гидроксид кадмия – гексаамминкадмия (2+) гидроксид.
10. Как устраняется временная и постоянная жесткость воды?
9.4 Лабораторные работы
1. Неметаллы
Окислительные свойства хлорной воды
К раствору синего лакмуса прилить равный объём хлорной воды и наб-людать переход синей окраски в красную, а затем исчезновение окраски. Объяснить наблюдаемые изменения. Чем отличается обесцвечивание красок хлором от обесцвечивания сернистым газом?
Извлечение брома растворителями
Налить в пробирку 3-4 мл бромной воды, 1 мл хлороформа и смесь сильно взболтать. В какой цвет окрашивается хлороформ?
Получение и окислительные свойства брома:
а) к 2 мл раствора бромида калия прибавить равный объем хлорной воды. В какой цвет окрашивается раствор? Прилить 1 мл хлороформа и взболтать. По данным опыта составить уравнения реакции.
б) к бромной воде прибавить щепотку порошка металлического маг-ния, цинка или алюминия и наблюдать обесцвечивание раствора. Составить уравнения реакции.
Растворимость йода
В пробирку с 2-3 мл воды опустить кристаллик йода и содержимое пробирки сильно взболтать. Происходит ли заметное растворение йода в воде? Добавить туда же небольшой кристаллик КI и через минуту взболтать раствор. Чем объясняется повышенная растворимость йода в растворе йодида калия?
Возгонка йода
В сухой стеклянный стакан (без носика) бросить 5-10 мл кристалликов йода и поставить его на асбестовую сетку, находящуюся на конце штатива. Сверху на стакан поставить круглодонную колбу с водой. Осторожно нагре-вать стакан небольшим пламенем. Вскоре весь стакан заполнится фиоле-товыми парами йода, а на стенках колбы осядут мелкие кристаллики субли-мированного йода, с течением времени укрупняющиеся в гроздья сросшихся кристаллов. Кристаллики йода со дна колбы сбросить стеклянной палочкой в склянку с притертой пробкой.
|
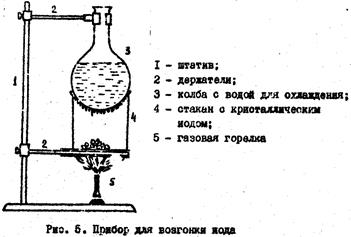
Прибор для возгонки йода
Сера
Восстановительные свойства серы
Налить в пробирку 2-3 мл концентрированной азотной кислоты, всы-пать немного порошка серы и нагревать смесь до кипения. К оставшемуся раствору прибавить раствор хлорида бария. На наличие какого иона указы-вает образование белого осадка? Составьте уравнение реакции окисления серы азотной кислотой.
Восстановительные свойства тиосульфата
К 2-3 мл раствора тиосульфата натрия прилить 1 мл раствора крахмала и приливать по каплям раствор йода. Почему не получается синего окраши-вания? Составьте уравнения реакции между тиосульфатом йода и йодом. К 2 мл раствора тиосульфата прибавить хлорную воду. Что наблюдается? Сос-тавьте уравнения реакции. Докажите, что в растворе имеются ионы SO42-, по-лучающиеся при окислении ионов S2O32-.
Окислительные свойства серной кислоты
Испытать действие разбавленной серной кислоты на металлический цинк и концентрированной серной кислоты на металлическую медь при на-гревании. Как определить продукты восстановления серной кислоты? Сос-тавьте уравнения реакций.
Обугливание органических веществ серной кислотой
Стеклянной палочкой, смоченной концентрированной H2SO4, написать что-нибудь на бумаге. Бумагу слегка прогреть, держа её высоко над пламе-нем. Что наблюдается? Дать объяснение. На кусочек ткани нанести стеклян-ной палочкой каплю концентрированной H2SO4. Через некоторое время ис-пытать ткань на прочность.
Азот и фосфор
Превращение красного фосфора в белый
В сухую пробирку поместить несколько крупинок красного фосфора, закрыть ватным тампоном и осторожно нагревать на слабом пламени. Наб-людать кристаллизацию вещества на холодных стенках пробирки и описать процесс, лежащий в основе опыта.
Равновесие в растворе аммиака
Отобрать пипеткой 2 мл концентрированного аммиака и разбавить во-дой, содержащей 3-4 капли раствора фенолфталеина, до 50 мл. Разлить окра-шенный раствор в три колбы. Одну поставить на печку кипятить раствор, а в другую высыпать щепотку твердого хлорида аммония и взболтать. Сравнить окраску во всех трех колбах и описать равновесия и смещение равновесия в растворе аммиака.
Образование солей аммония
Стеклянную палочку смочить концентрированной соляной кислотой и поднести к склянке с концентрированным раствором аммиака. Описать наб-людаемые изменения и составить уравнение реакции.
Получение аммиакатов
В двух пробирках получить осадки гидроксидов цинка и никеля и при-лить к ним раствор аммиака. Описать происходящие изменения и составить уравнения реакций.
Окислительные свойства азотной кислоты
В 5 мл дистиллированной воды растворить 3-4 кристалла свежепере-кристаллизованной соли железа (II). Раствор разлить поровну в две пробир-ки. В одну из них добавить 5 капель концентрированной азотной кислоты и кипятить 2-3 мин. После охлаждения прилить в обе пробирки по несколько капель раствора роданида калия и наблюдать за изменением окраски.
Образование азотной кислоты и ее разложение
К 3-4 мл концентрированного раствора NaNO2 прилить разбавленную серную кислоту. Наблюдать изменение окраски раствора (на фоне белой бу-маги) и записать уравнения реакций.
Реакция открытия азотной кислоты
Налить в пробирку 1 мл насыщенного раствора сульфата железа (II),
3 мл концентрированной серной кислоты, охладить смесь. Наклонив пробир-ку, осторожно влить по стенке 1-2 мл раствора азотной кислоты (1:1). В месте соприкосновения двух жидкостей образуется бурое кольцо [Fe(NO)]SO4. Записать уравнение реакции в две стадии: восстановление азотной кислоты до оксида азота (II) и образование комплексного соединения.
2. Металлы
Восстановительные свойства меди:
а) опыт проводить под тягой! Испытать действие разбавленной и концентрированной серной и азотной кислот на металлическую медь на холоде и при нагревании. Записать уравнения проведенных реакций;
б) взять щипцами кусочек медной проволоки и прокалить в муфельной печи. Записать уравнение реакции.
Гидролиз солей меди и серебра:
а) испытать лакмусовой бумагой растворы солей меди (II) и серебра. Отметить и записать уравнения реакций гидролиза;
б) к концентрированному раствору сульфата меди прилить насыщенный раствор соды. Описать реакцию взаимного гидролиза, учитывая, что осаждается основной карбонат меди.
Окислительные свойства иона Си2+
К раствору сульфата меди (II) добавить раствор йодида калия. При этом образуется белый осадок Cu2J2 и наблюдается пожелтение раствора. Составьте уравнение реакции.
Окрашивание пламени солями меди
Нихромовую проволоку окунуть в раствор хлорида меди (II) и внести в пламя горелки. Фиксировать окрашивание пламени.
Восстановительные свойства цинка
В трёх отдельных пробирках изучить действие воды, соляной кислоты и концентрированного раствора щелочи на металлический цинк. Записать уравнения реакций и предсказать отношение кадмия к этим же реактивам.
Получение гидроксидов
К растворам солей ZnCl2, CdCl2, Hg(NO3)2, Hg2(NO3)2 прибавить по нес-колько капель раствора щелочи и записать уравнения реакции. Затем ко всем осадкам прилить избыток щелочи, зафиксировать различия в поведении гид-роксидов цинка, кадмия и ртути.
Дата добавления: 2015-10-21; просмотров: 1001;
