Равновесия в растворах комплексных соединений
Внешнесферная диссоциация комплексных солей происходит в водных растворах практически полностью, например: [Ag(NH3)2]Cl ® [Ag(NH3)2]+ + Cl-.
Эта диссоциация называется первичной. Обратимый распад внутрен-ней сферы комплексного соединения называют вторичной диссоциацией. Например, ион диамминсеребра диссоциирует ступенчато по схеме:
[Ag(NH3)2]+ ⇄ [Ag(NH3)]+ + NH3 - первая ступень;
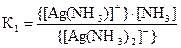 ;
;
[Ag(NH3)]+ ⇄ Ag+ + NH3 - вторая ступень;
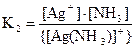 .
.
Суммируя две стадии диссоциации, получаем в общем виде выраже-ние для константы равновесия, называемой константой нестойкости ком-плексного иона:
[Ag(NH3)2]+ ⇄ Ag+ + 2NH3

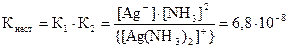 .
.
Величину, обратную константе нестойкости, называют общей кон-стантой устойчивости. Очевидно, чем большую устойчивость проявляет комплексный ион, тем меньше его константа неустойчивости и больше константа устойчивости.
Сравнение величин константы равновесия дает возможность количест-венно обосновать направление смещения равновесия в системах, содержа-щих комплексные ионы. Так, в реакции
[HgCl4]2- + 4J- ⇄ [HgJ4]2- + 4Cl-
K=8,5×10-16 K=1,5×10-30
равновесие практически полностью смещено в сторону образования значительно более устойчивого комплексного иона [HgJ4]2-.
8.2 Примеры решения типовых задач
Задача 1. Назвать комплексные соединения:
Решение
[PtCl3(NH3)3]Br - трихлоротриамминплатины (IV) бромид;
Ba[Cr(SCN)4(NH3)2]2 - бария тетратиоцианатодиамминхромат (III);
[CoF3(H2O)3] - трифторотриаквокобальт;
[Pd(NH3)4][PdCl(NO2)3] - тетраамминпалладия (II) тринитрохлоропалладат (II).
Задача 2. Химические названия желтой и красной кровяной соли: калия гексацианоферрат (II) и калия гексацианоферрат (III). Написать формулы этих солей.
Решение. K4[Fe(CN)6] и K3[Fe(CN)6].
Задача 3. Координационное число кобальта (III) равно шести. Соста-вить возможные формулы комплексного соединения CoBr3 × 4NH3 × 2H2O.
Решение. [CoBr2(NH3)4] Br×2H2O; [Co (H 2O)2 (NH3)4] Br3;
[CoBr (H 2O )(NH3)4] Br2 H 2O.
Задача 4. Вычислить концентрацию ионов Ag+ в 0,1 М растворе
[Ag(NH3)2]NO3, содержащем дополнительно 1 моль/л аммиака. Константа не-устойчивости иона [Ag(NH3)2]+ составляет 6,8×10-8.
Решение. Так как комплексная соль диссоциирует на внешнюю и внут-реннюю сферы как сильный электролит по схеме: [Ag(NH3)2]NO3 ⇄ [Ag(NH3)2]+ + NO3-, то концентрация аммиачного комплекса в растворе при-нимается равной комплексной соли – 0,1 моль/л. Определим равновесные концентрации ионов комплексной частицы в присутствии аммиака:
СМ , моль/л [Ag(NH3)2]+ ⇄ Ag+ + 2NH3
Исходная 0,1 - 1,0
В диссоциации х х х
В равновесии (0,1 – х) х (1,0+х)
Согласно условию задачи 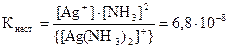 . В присутствии избыточного NH3 равновесие диссоциации [Ag(NH3)2]+ ⇄ Ag+ + 2NH3 настолько сильно смещено влево, что можно пренебречь той ничтожно малой концентрацией аммиака, которая получается за счет диссоциации комплекса, и принять ее равной 1 моль/л. Считая [Ag(NH3)2]NO3 сильным электролитом и пренебрегая той долей комплексных ионов, которые подверглись диссоциации, можно приравнять концентрацию недиссоциированной части ионов [Ag(NH3)2]+ к общей концентрации этих ионов, т.е. 0,1 моль/л. Отсюда
. В присутствии избыточного NH3 равновесие диссоциации [Ag(NH3)2]+ ⇄ Ag+ + 2NH3 настолько сильно смещено влево, что можно пренебречь той ничтожно малой концентрацией аммиака, которая получается за счет диссоциации комплекса, и принять ее равной 1 моль/л. Считая [Ag(NH3)2]NO3 сильным электролитом и пренебрегая той долей комплексных ионов, которые подверглись диссоциации, можно приравнять концентрацию недиссоциированной части ионов [Ag(NH3)2]+ к общей концентрации этих ионов, т.е. 0,1 моль/л. Отсюда
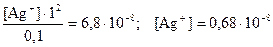 моль/л.
моль/л.
8.3 Лабораторная работа
Ход работы
1. Получить комплексные соединения Cu2+, Ni2+, Zn2+, Cd2+ (исполь-зовать 25%-й водный раствор аммиака; 0,5 М растворы нитратов меди, нике-ля, цинка, кадмия). К полученным растворам добавить раствор щёлочи (2 М). Координационные числа указанных ионов соответственно равны 4, 6, 4, 6.
2. Реакцией обмена получить MgCO3. Из образовавшегося осадка полу-чить аммиачный комплекс Mg2+, добавив избыток (NH4)2CO3. Для опыта ис-пользовать 0,5 М раствор хлорида магния и 1 М раствор карбоната аммония.
3. Реакцией обмена получить осадки гидроксидов Zn2+, Cr3+, Al3+, Sn2+, Pb2+. Для опыта использовать 0,5 М растворы нитратов соответствующих ка-тионов и 2 М раствор гидроксида натрия. Используя раствор гидроксида натрия, получить из гидроксидов комплексные соединения.
4. Поместить в пробирку 2-3 капли раствора Na2S2O3 и прибавить к нему каплю раствора хлорида железа (III). Моментально появляется тёмное фиолетовое окрашивание, которое постепенно в течение нескольких минут исчезает. Раствор становится бесцветным. Проделать этот опыт, предвари-тельно прибавив к исследуемому раствору 1 каплю раствора CuSO4, при этом фиолетовое окрашивание раствора практически не появляется, а если и поя-вится, то мгновенно исчезает. Чем объясняется появление окраски раствора?
5. Прилить к 2-3 каплям раствора какой-нибудь соли кобальта (II) 2-3 капли раствора уксусной кислоты, 5 капель раствора нитрита калия и потереть стеклянной палочкой о стенки пробирки. Что наблюдается?
6. Налить в пробирку 2-3 капли соли Са2+, прибавить 5 капель буфер-ной смеси (NH3·H2O+NH4Cl) и 2-3 капли насыщенного раствора К4[Fе(СN)6]. Что образуется? Проверить отношение осадка к уксусной кислоте.
7. Поместить в пробирку 2-3 капли соли Zn2+, прибавить 2-3 капли раствора К4[Fе(СN)6] и нагреть смесь до кипения. Что образуется?
8. Поместить в пробирку 2-3 мл свежеприготовленной соли Мора и прибавить 2-3 капли К3[Fe(СN)6]. Содержимое разбавить дистиллированной водой. Каков цвет осадка и как он называется?
9. В пробирку внести 2-3 мл раствора FeCl3 и прибавить 2-3 капли раствора К4[Fе(СN)6]. Содержимое пробирки разбавить водой. Каков цвет осадка и как он называется? Напишите уравнение реакции.
10. Проверить экспериментально возможность участия комплексных соединений в ОВР. Для исследований использовать: 0,1 М растворы перман-ганата калия, гексацианоферрата (II) калия и 10 %-й раствор серной кислоты.
Контрольные вопросы
1. Что такое комплексное соединение (внешняя и внутренняя сферы, комплексообразователь и лиганды, координационное число и заряд комплексообразователя)?
2. Типы комплексных соединений. Приведите примеры.
3. Номенклатура комплексных соединений. Приведите примеры.
4. Равновесия в растворах комплексных соединений. Чем они характе-ризуются?
5. Какие факторы влияют на смещение этих равновесий?
6. Как влияет природа лиганда на возможность образования комплек-сных соединений в растворе?
8.4 Задачи для самостоятельного решения
1. Назвать комплексные соединения: a) [PdCl(H2O)(NH3)2]Cl;
б) [Co(CN)2(NH3)4]Br; в) [Pt(SO4)(NH3)4]Br2; г) (NH4)2[PtCl4(OH)2];
д) K2[Zn(OH)2(SCN)2]; e) H2[Fe(CN)5NO]; ж) [Cr(PO4)(H2O)4]; и)[CoF3(H2O)3];
к) [Cr(NH3)4(SCN)Cl](NO3)2.
2. Представьте координационные формулы следующих соединений:
2NH4Cl × PtCl4, K2C2O4 ×Cu C2O4, KCl × AuCl3, 2Ca(CN)2 × Fe(CN)2.
3. Напишите формулы следующих комплексных соединений: а) натрия триоксалатокобальтат (III), б) пентаамминаквоникеля (II) cульфат, в) калия тетратиоцианатодиаквохромат (III), г) гексааммин кобальта (III) тетранитро-диамминкобальтат (III).
4. Каков механизм образования донорно-акцепторной связи? Укажите донор и акцептор в следующих комплексных ионах: [SiF6]2-, [Ni(NH3)6]2+ , [HgI4]2-.
5. Какие из приведенных частиц могут быть лигандами и какие акцеп-торами в координационных соединениях: Co3+, Ni2+, CN-, Si4+, NO2-, B3+, NH3?
6. Написать уравнение реакции в молекулярной и ионно-молекулярной форме, а также выражение константы нестойкости КН образующегося комп-лексного иона: [Ag(NH3)2]Cl + K2S2O3 ® …Назвать это соединение.
7. Написать уравнения реакций, с помощью которых можно после-довательно из CaF2, SiO2, KOH и H2SO4 получить комплексное соединение К2[SiF6]. Назвать это соединение.
8. Напишите уравнения реакций при растворении AgCl в растворах ам-миака и цианида калия. Назовите образующиеся комплексные соединения и напишите для них выражение константы нестойкости.
9. На осаждение ионов Br- из раствора комплексной соли [Cr(H2O)6]Br3 израсходовано 0,025 л раствора нитрата серебра с массовой долей AgNO3, равной 10 % (r =1088 кг/м3). Какая масса комплексной соли содержалась в растворе? (Ответ: 2,13).
10. Константа неустойчивости иона [Ag(S2O3)2]3- составляет 3,5×10-14. Сколько граммов серебра содержится в виде ионов в 1 л 0,1 М раствора Na3[Ag(S2O3)2], содержащем, кроме того, 25 г Na2S2O3 × 5H2O. (Ответ: 3,8 × 10-11).
Дата добавления: 2015-10-21; просмотров: 2485;
