Примеры решения типовых задач. При решении задач по теме «Растворы» можно пользоваться следу-ющими формулами:
При решении задач по теме «Растворы» можно пользоваться следу-ющими формулами:
определение количества вещества (число молей):
n = 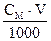 , где СМ – молярная концентрация (моль/л), V– объем раствора (мл);
, где СМ – молярная концентрация (моль/л), V– объем раствора (мл);
n= 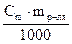 , где Сm – моляльная концентрация (моль/л), mр-ля - масса растворителя;
, где Сm – моляльная концентрация (моль/л), mр-ля - масса растворителя;
n = 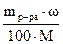 , где mр-ра - масса раствора (г), w - массовая доля растворенного вещества (%), М – молярная масса вещества (г/моль);
, где mр-ра - масса раствора (г), w - массовая доля растворенного вещества (%), М – молярная масса вещества (г/моль);
n = 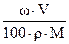 , где w - массовая доля вещества (%), М – молярная масса вещества (г/моль), V – объем раствора (мл), r - плотность раствора (г/мл).
, где w - массовая доля вещества (%), М – молярная масса вещества (г/моль), V – объем раствора (мл), r - плотность раствора (г/мл).
Определение количества молей эквивалентов растворенного вещества:
nэкв. = 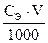 , где СЭ - молярная концентрация эквивалента или Сн - нормальная концентрация (моль/л), V – объем раствора (мл);
, где СЭ - молярная концентрация эквивалента или Сн - нормальная концентрация (моль/л), V – объем раствора (мл);
nэкв. = n×d, где d = 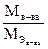 (
( 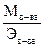 ).
).
Закон эквивалентов для индивидуальных веществ записывается так:
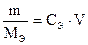 , где V – объем раствора в литрах.
, где V – объем раствора в литрах.
Задача 1. Сколько граммов соли выкристаллизуется при охлаждении до 30 0С 400 г насыщенного при 95 0С раствора, если растворимость равна: при 95 0С – 40 г, при 30 0С – 20 г на 100 г раствора.
Решение. Рассчитываем массу соли и воды в 400 г раствора при 95 0С.
В 100 г раствора содержится 40 г соли
400 г ¾ х г
х = 160 г (соли); воды содержится: 400-160=240 (г).
Масса воды при перекристаллизации сохранится и будет равна 240 г. Находим количество соли, которое может раствориться в 240 г воды при
30 0С.
В 100 г раствора содержится 20 г соли
(240+х) г ¾ х г
х = 60 г. Выкристаллизуется: 160 – 60 = 100 (г) соли.
Задача 2. Вычислить массовую долю (процентную концентрацию), молярность, молярную концентрацию эквивалента (нормальность), моляль-ность, мольную долю и титр раствора ортофосфорной кислоты, полученного при растворении 18 г кислоты в 282 мл воды, если плотность его раствора равна 1,032 г/см3.
Решение. Определяем массовую долю раствора Н3РО4 по формуле:
w(%) = 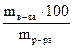 ; mв-ва = 18 г, mр-ра = mк-ты + mводы; mводы=Vводы, т.к. rводы=
; mв-ва = 18 г, mр-ра = mк-ты + mводы; mводы=Vводы, т.к. rводы=
1 г/см3 ; w(Н3РО4) = 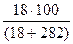 = 6 %.
= 6 %.
Определяем молярность раствора по формуле: СМ = 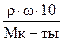 =
= 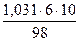 = 0,63 моль/л.
= 0,63 моль/л.
Определяем молярную концентрацию эквивалента кислоты по формуле: СЭ = СМ×d, где d = 3 из формулы молярной концентрации эквива-лента ортофосфорной кислоты МЭ(Н3РО4) = М/3. СЭ(Н3РО4) = 0,63 × 3 = 1,89 моль/л.
Определяем моляльность Н3РО4 по формуле: Сm = 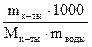 =
= 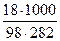 = 0,65 моль/л.
= 0,65 моль/л.
Определяем мольную долю в растворе Н3РО4 по формуле: cк-ты = 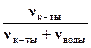 ; nк-ты = mк-ты/Мк-ты = 18/98 = 0,184 (моль), nводы = mводы/Мводы =
; nк-ты = mк-ты/Мк-ты = 18/98 = 0,184 (моль), nводы = mводы/Мводы =
= 282/18 = 15,67 (моль). 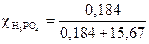 = 0,012 или 1,2 %.
= 0,012 или 1,2 %.
Определяем титр раствора: Т = mк-ты./Vр-ра. Vр-ра = mр-ра/rр-ра = 300/1,031 = 290,98 мл. Т = 18/290,98 = 0,06186 г/мл.
Задача 3. Сколько граммов К2CO3 необходимо для взаимодействия с 200 мл раствора HCl, молярная концентрация эквивалента которого 2 моль/л.
Решение. По закону эквивалентов: 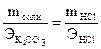 = VHCl×CЭ,HCl. Из приведенного соотношения находим массу К2СО3, предварительно определив молярную массу эквивалента по формуле:
= VHCl×CЭ,HCl. Из приведенного соотношения находим массу К2СО3, предварительно определив молярную массу эквивалента по формуле: 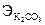 = М/2 = 138/2 = 69 (г/моль).
= М/2 = 138/2 = 69 (г/моль).
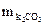 = VHCl × СHCl ×
= VHCl × СHCl × 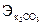 = 0,2 (л) × 2 (моль/л) × 69 (г/моль) = 27,6 (г).
= 0,2 (л) × 2 (моль/л) × 69 (г/моль) = 27,6 (г).
Задача 4. Какой объем 3,65 % раствора соляной кислоты, плотность которого 1,01 г/см3, необходимо для полного разложения 50 г карбоната кальция?
Решение. Используем закон эквивалентов, предварительно пересчи-тывая концентрацию кислоты из массового процента в молярную кон-центрацию эквивалента: 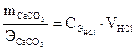 ;
; 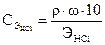 =
= 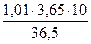 = 1,01 (моль/л);
= 1,01 (моль/л);
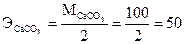 (г/моль);
(г/моль); 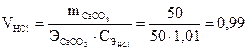 (л).
(л).
Задача 5. Сколько литров раствора КОН, молярная концентрация эквивалента которого 6 моль/л (6 н), следует добавить к 4,5 л раствора КОН с молярной концентрацией эквивалента 0,8 моль/л, чтобы полученный раствор оказался с молярной концентрацией эквивалента 2 моль/л.
Решение. Используем правило «креста»:
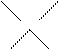 6,0 1,2
6,0 1,2
2 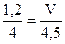 V = 1,35 (л)
V = 1,35 (л)
0,8 4,0
Задача 6. Сколько граммов Na2CO3×10 Н2О необходимо растворить в 50 г воды для получения 5 % раствора из кристаллогидрата?
Решение. При решении задачи учитываем, что общая масса растворителя состоит из 50 г воды и той массы воды, которая внесена с кристаллогидратом (крг.). Обозначим массу растворенного кристаллогидрата через mкрг. (г). Из молекулярной формулы следует, что число молей крис-таллогидрата и безводной соли одинаково, а молей воды в 10 раз больше: Na2CO3×10 H2O ® Na2CO3 + 10 H2O
1 моль 1 моль 10 моль
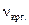 .=
.= 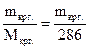 ;
; 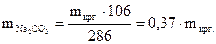 ;
; 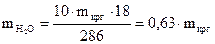 .
.
Составим уравнения из соотношения:
раствор Na2CO3 H2O
100 г 5 г 95 г ® т.к. 5% раствор Na2CO3.
(mкрг.+50) г (0,37×mкрг.) (50+0,63×mкрг.) г
100 × 0,37×mкрг. = 5 × (mкрг.+50);
5 × (50+0,63×mкрг.) = 95 × 0,37×mкрг.;
95 × (mкрг.+50) = 100 × (50+0,63×mкрг.).
Решение любого из этих трех уравнений дает ответ: mкрг. = 7,80 (г).
Эту задачу можно также решить, используя правило «креста», так как кристаллогидрат является раствором Na2CO3 в кристаллизационной воде:
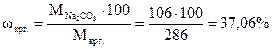 . Составляем «крест»:
. Составляем «крест»:
wкрг. 5 37,06 5
 5 ® 5 ®
5 ® 5 ® 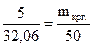 ;
;
0 (wкрг.-5) 0 32,06 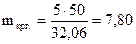 (г).
(г).
Дата добавления: 2015-10-21; просмотров: 903;
