Рекомендации к изучению теоретического материала. Раствором называется гомогенная система, состоящая из двух или более компонентов
Раствором называется гомогенная система, состоящая из двух или более компонентов. Всякий истинный раствор включает растворенное вещество и растворитель, которые равномерно распределены между собой в виде молекул или ионов с размером частиц 10-7 – 10-8 см. Деление компонентов раствора на растворенное вещество и растворитель условно. Обычно растворителем считают тот компонент, который в чистом виде находится в том агрегатном состоянии, что и раствор. Если же агрегатные состояния компонентов одинаковы, то растворителем считается находящийся в большем количестве компонент. В зависимости от агрегатного состояния растворы делятся на газообразные, жидкие и твердые. Такое деление не зависит от агрегатного состояния всех компонентов раствора, а определяется агрегатным состоянием растворителя. Например, растворы газа в жидкости и твердого вещества в жидкости относятся к жидким растворам.
Количественные соотношения между растворенным веществом и растворителем определяются концентрацией раствора. Растворы с большой концентрацией растворенного вещества называются концентрированными, а с малой концентрацией – разбавленными. Когда раствор находится в динамическом равновесии с одним из компонентов раствора, он называется насыщенным, а его концентрация соответствует растворимости этого компонента. Растворимость – это масса растворенного вещества в 100 г растворителя в насыщенном растворе. Иногда растворимость выражают массовой долей растворенного вещества в растворе или молярной концентрацией. 


Растворение большинства твердых тел сопровождается поглощением теплоты, т.к. энергия, затраченная на разрушение кристаллической решетки, больше выделяющейся при образовании сольватов. Поэтому при повышении температуры растворимость возрастает. Объем системы при растворении твердых веществ изменяется незначительно, поэтому растворимость практически не зависит от давления.
Повышение температуры увеличивает взаимную растворимость в системе жидкость-жидкость, а давление существенно на растворимость не влияет.
Растворение газов в воде – экзотермический процесс, поэтому повышение температуры снижает растворимость газов. При растворении газа в жидкости объем системы существенно уменьшается, следовательно, повышение давления увеличивает растворимость газа.
Для количественной характеристики растворов применяют следующие способы выражения концентрации.
1. Доли – мольная, объемная и массовая. Массовая доля (или процентная концентрация) широко используется в практике приготовления растворов: 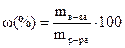 . Массовая доля (w,%), или процентная конце-нтрация, показывает, что в 100 г раствора содержится растворенное вещество в количестве (г), равном его массовой доле (w,%).
. Массовая доля (w,%), или процентная конце-нтрация, показывает, что в 100 г раствора содержится растворенное вещество в количестве (г), равном его массовой доле (w,%).
2. Моляльность (моляльная концентрация) – число молей растворен-ного вещества в 1000 г растворителя.
 Cm =
Cm = 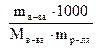 (моль/кг), где mв-ва – масса вещества в г;
(моль/кг), где mв-ва – масса вещества в г;
mр-ля- масса растворителя в г; Мв-ва- молярная масса вещества в г/моль.
3. Молярность (молярная концентрация) – число молей растворенного вещества в 1 л раствора: СМ = n/V (моль/л), где V - объем раствора в л или
СМ =  (моль/л), где V – объем раствора в мл.
(моль/л), где V – объем раствора в мл.
4. Молярная концентрация эквивалента (нормальность) – число молей эквивалентов растворенного вещества в 1 л раствора:
СЭ = 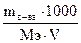 (моль/л), где МЭ – молярная масса эквивалента растворенного вещества; V – объем раствора в мл. Иногда в качестве обозначения используют символ СН. Для растворов выполняется соотношение из закона эквивалентов:
(моль/л), где МЭ – молярная масса эквивалента растворенного вещества; V – объем раствора в мл. Иногда в качестве обозначения используют символ СН. Для растворов выполняется соотношение из закона эквивалентов:  .
.
5. Титр раствора – число граммов растворенного вещества в 1 мл раствора (г/мл) или в 1 л раствора (г/л) и обозначается символом Т
(Т= 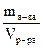 )
)
При выполнении экспериментальных работ часто приходится рас-считывать концентрацию раствора, образующегося при разбавлении, концентрировании или смешивании двух растворов. В этом случае можно использовать правило «креста»:
С1 (С3-С2) С1 и С2 – концентрации исходных растворов,
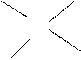 С3 С3 – концентрация конечного раствора, причем
С3 С3 – концентрация конечного раствора, причем
С2 (С1-С3) С1 > С3, а С3 > С2.
Далее составляем соотношение:


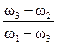 =
= 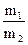 - для массовой доли раствора;
- для массовой доли раствора; 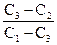 =
= 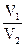 - для объемных концентраций СМ или СЭ. В случае разбавления раствора растворителем значение С2 или w2 принимается равным нулю, а при концентрировании растворенным веществом значение w1(%) равно 100 (для растворов с массовой долей). В приведенных соотношениях m1 и m2 – массы растворов с массовой долей w1 и w2; V1 и V2 – объемы растворов с молярной концентрацией С1 и С2.
- для объемных концентраций СМ или СЭ. В случае разбавления раствора растворителем значение С2 или w2 принимается равным нулю, а при концентрировании растворенным веществом значение w1(%) равно 100 (для растворов с массовой долей). В приведенных соотношениях m1 и m2 – массы растворов с массовой долей w1 и w2; V1 и V2 – объемы растворов с молярной концентрацией С1 и С2.
Каждый раствор характеризуется своей плотностью (r) – отношение массы раствора к его объему - и измеряется в г/см3 (г/мл) или в кг/м3 (в системе СИ). Чтобы получить формулу пересчета двух типов концентраций (массовой и объемной), необходимо перейти к одинаковым единицам величин: r (г/см3), М (г/моль), w (%), V (мл). Составляем пропорцию, исходя из значений масс растворенного вещества и раствора:
раствор растворенное вещество формула пересчета
100 (г) ¾ w,% (г)
1000×r (г) ¾ СМ×М (г) СМ = 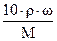
Таким же способом получаем формулу для молярной концентрации эквивалента: СЭ=  , где МЭ - молярная масса эквивалента растворенно-го вещества.
, где МЭ - молярная масса эквивалента растворенно-го вещества.
Дата добавления: 2015-10-21; просмотров: 753;
