Рекомендации к изучению теоретического материала. Оксиды - бинарные гетеросоединения, молекула которых состоит из атомов элемента в степени окисления от 1 до 8 и кислорода в степени окисления -2
Оксиды - бинарные гетеросоединения, молекула которых состоит из атомов элемента в степени окисления от 1 до 8 и кислорода в степени окисления -2. Учтите, что оксиды делятся на солеобразующие - в реакции с оксидами, основаниями и кислотами образуют соли - и несолеобразующие. К последним относятся некоторые из оксидов неметаллов в низших степенях окисления (N2O, NO, SiO и т.д.). По кислотно - основной активности солеобразующие оксиды подразделяются на основные, кислотные и амфотерные. К основным относят оксиды щелочных, щёлочно - земельных элементов, магния и металлов в низших степенях окисления (не выше двух). Следует иметь в виду, что связь в таких оксидах преимущественно ионная и в кислотно - основных реакциях элемент, образующий оксид, попадает в состав катиона. Кислотные оксиды образуют неметаллы и металлы в высших степенях окисления (обычно больше четырех), связь в них преимущественно ковалентная и в кислотно - основных реакциях элемент оксида попадает в состав аниона. Амфотерные оксиды образованы металлами в промежуточной степени окисления (чаще всего три или четыре, реже один или два), связь в них смешанная ионо-ковалентная и они, в зависимости от реакции, могут попадать в состав как катиона, так и аниона.
Основные способы получения оксидов:
1. Взаимодействие гомосоединений с кислородом:
Mg + O2 → 2MgO
2. Окисление водородсодержащих соединений, сульфидов и фосфидов:
2H2S + 3O2 → 2SO2 + 2H2O
2ZnS + 3O2 → 2ZnO + 2SO2
Ca3P2 + 4O2 → 3CaO + P2O5
3. Окисление низших оксидов до высших:
4VO + 3O2 → 2V2O5
4. Восстановление высших оксидов до низших:
Cr2O3 + H2 → 2CrO + H2O
4CrO3 → 2Cr2O3 + 3O2
5. Разложение кислот, оснований, амфотерных гидроксидов:
H2WO4 → WO3 + H2O
2Al(OH)3 → Al2O3 + 3H2O
Mg(OH)2 → MgO + H2O
Отметьте, что в случае получения термически неустойчивых оксидов на кислоту действуют водоотнимающим средством:
2НNO3 + P2O5 → 2HPO3 + N2O5
2HClO4 + P2O5 → 2HPO3 + Cl2O7
6. Разложение солей кислородсодержащих кислот:
CaCO3 → CaO + CO2
2NH4VO3 → V2O5 + 2NH3 + H2O
7. Разложение или восстановление пероксидов:
2BaO2 → 2BaO + O2
Na2O2 + Na → 2Na2O
8. Взаимодействие солей с оксидами:
Ca3(PO4)2 + 3SiO2 → 3CaSiO3 + P2O5
При рассмотрении химических свойств оксидов следует учитывать их отнесение к основным, кислотным и амфотерным.
1. Реакция с водой (некоторые из основных или кислотных):
Na2O + H2O → 2NaOH
SO3 + H2O → H2SO4
2NO2 + H2O → HNO3 + HNO2
2. Реакция с кислотами (основные, амфотерные) и основаниями (кислотные, амфотерные):
BaO + 2HNO3 → Ba(NO3)2 + H2O
SO2 + Ca(OH)2(p) → CaSO3 + H2O
Cr2O3 + 6NaOH(p) + 3H2O → 2Na3[Cr(OH)6]
CO2 + NaOH → NaHCO3
2Mg(OH)2 + CO2 → (MgOH)2CO3 + H2O
3. Реакции между оксидами (кислотные с основными, амфотерные с основными и кислотными):
Fe2O3 + 3SiO2 → Fe2(SiO3)3
Al2O3 + FeO → Fe(AlO2)2
4. Сплавление с солями летучих кислот или оснований:
2(NH4)3PO4 + 3CaO → Ca3(PO4)2 + 6NH3 + 3H2O
Al2O3 + K2CO3 → KAlO2 + CO2
5. Особые случаи реакций:
SiO2 + 4HF → SiF4 + 2H2O
Al2O3 + 6NaHSO4 → Al2(SO4)3 + 3Na2SO4 + 3H2O
Cr2O3 + 3K2S2O7 → Cr2(SO4)3 + 3K2SO4
Fe2O3 + 3CO → 2Fe + 3CO2
FeO + 4HNO3 (k) → Fe(NO3)3 + NO2 + 2H2O
Кислотами называют соединения, которые содержат ионы водорода, способные замещаться на катионы. Кроме ионов водорода, в их состав входит кислотный остаток, который в кислотно - основных реакциях попадает в состав солей. По числу подвижных ионов водорода кислоты делятся на одно-, двух-, трёх- ... полиосновные. Учтите, что деление кислот на кислородсодержащие и бескислородные не совсем удачно, хотя и допустимо. Как и основания, ряд кислот хорошо растворимы в воде ( HCl, HNO3, H2SO4, НClO4 и т.д.), а некоторые - плохо ( Н4SiO4, H2SiO3, H2WO4 и
т.д.). По способности диссоциировать в водных растворах на ионы водорода и кислотного остатка кислоты подразделяются на слабые и сильные. В сильных кислотах связь водорода с кислотным остатком преимущественно ионная, а в слабых - ковалентная. Запомните, что к слабым бескислородным кислотам относятся HF, H2S, HCN, а к сильным - НВг, HCl, HI, HSCN. В случае кислородсодержащих кислот, имеющих общую формулу (OН)nЭOm, к сильным относятся те, у которых m>n ( HNO3, HClO3, НСlO4), кслабым - те, у которых m<n( HClO, H3PO4, H2CO3). Если m = n, то одноосновные кислоты - слабые ( НСlO2, HNO2 ), а двухосновные - сильные (Н2SO4, H2CrO4). При определении основности кислоты будьте внимательны - ни в коем случае не устанавливайте её по общему количеству ионов водорода. Так, фосфористая кислота (Н3РО3) - двухосновна, фосфорноватистая (Н3РО2) - одноосновна, уксусная (Н4С2О2) - одноосновна и т.д. Отдельную группу кислот составляют изо- и гетерополикислоты - полимерные кислоты, анионы которых построены из полиэдров (чаще всего тетраэдров или октаэдров), связанных друг с другом вершинами, рёбрами и реже - гранями. Если полиэдры одного сорта, то образуются изополикислоты (Н2S2O7, H3P3O10, H3V3O9), если разного – то гетерополикислоты (Н4SiW3O13, H3PW12O40). Кроме того, замещение одного или нескольких кислородов в монокислоте сульфид-ионами или пероксид-ионами приводит к образованию тио- ( H2S2О3 - тиосерная кислота) и пероксокислот (Н2SO5 - пероксомоносерная кислота).
Названия кислот образуются от русских названий кислотообразующего элемента с суффиксом, характеризующим его степень окисления, окончания -ая и слова «кислота». По мере понижения степени окисления используют суффиксы: -н; -ев; -ов; -оват; -новат; -ист; -новатист. Если известно несколько кислот без изменения степени окисления кислотообразующего элемента, то кислота с максимальным содержанием протонов относится к орто-, а с минимальным - к метакислотам. При этом учтите, что метакислоты - полимерные. В международной номенклатуре название образуется из латинского названия кислотообразующего элемента, суффиксов -ат (высшая степень окисления), -ит (низшая), окончания -ная и слова «кислота». Если элемент проявляет более двух степеней окисления, то добавляются приставки гипо- (низшая) и пер- (высшая). Бескислородные кислоты имеют суффикс -ид. Рассмотрим названия некоторых кислот: HCl - соляная или хлоридная кислота; HNO3 - азотная или нитратная кислота; НNO2 - азотистая или нитритная кислота; НClO4 - хлорная или перхлоратная кислота; HClO3 - хлорноватая или хлоратная кислота; НСlО2 - хлористая или хлоритная кислота; HClO - хлорноватистая или гипохлоритная кислота; H3РО4 - ортофосфорная или ортофосфатная кислота; H3P3O9 (НРО3) - метафосфорная или триметафосфатная кислота; H4P2O7 - пирофосфорная или диполифосфатная кислота.
Следует обратить внимание на генетическую связь кислот и кислотных оксидов, которые в этом случае называют ангидридами кислот. Это связано с тем, что тогда кислоту можно рассматривать как продукт взаимодействия оксида с водой. Кроме того, не всякомукислотному оксиду соответствует кислота и не всякая кислота имеет ангидрид. Так, оксиду МnО3 соответствует гипотетическая кислота H2MnO4, хотя ее соли манганаты хорошо известны, а кислоте Н3РO2 - гипотетический ангидрид Р2О.
Запомните способы получения кислот:
1. Взаимодействие кислотных оксидов с водой:
SO3 + Н2O = Н2SO4
2NO2 + Н2O = НNO3 + HNO2
2СгO3 + H2О = Н2Сг2О7
Учтите, что ряд кислотных оксидов непосредственно с водой не взаимодействуют (SiO2, V2O5, WO3 и т.д.).
2. Взаимодействие между солями и кислотами:
FеS + 2НCl = FеCl2 + Н2S
К2НPO4 + H2SО4 = K2SO4+ H3PO4
3Ca(NO3)2 + 2Н3РO3 = Ca3(PO4)2↓ + 6HNO3
PtCl4 + 2НCl = H2[PtCl6]
В этом случае среди продуктов реакции должен быть осадок или слабый электролит.
3. Соединение неметаллов с водородом и растворение образовавшегося продукта в воде:
Н2 + С12 = НС1
Н2 + S = Н2S
4. Взаимодействие активных неметаллов с водой:
С12 + Н2O ↔ НC1 + НСlО
2F2 + 2Н2O = 4НF + O2,
5. Окисление металлов и неметаллов кислотами:
3J2 + 10HNO3 = 6HJO3 + 10NO + 2H2O;
Au + 4HC1 + НNO3 = Н[AuС14] + NO +2H2O;
Sb + 5HNO3(к) →HSbO3 + 5NO2 +2H2O.
6. Гидролиз кислотных галогенидов:
PC15 + 4H2О = 5HC1 + H3PO4
2AsJ3 + 3H2O = 6HJ + As2O3
7. Частичное отщепление воды от кислот:
3H3PO4 = H3P3O9 + 3H2O
2H3VO4 = H4V2O7 + H2O
8. Взаимодействие кислотных оксидов с их кислотами:
Н2СгO4 + СгO3 = Н2Сг2O7
4Н3PO4 + 4Р2O5 = 3Н4P4О12
При рассмотрении химических свойств кислот следует учитывать их диссоциацию в водном растворе с образованием катионов водорода и анионов кислотного остатка:
1. Взаимодействие кислот с основаниями и амфотерными гидроксидами:
Ва(OН)2 + Н2SO4 = ВаSO4↓ + 2H2O
Ва(ОН)2 +2Н2SO4 = Ва(НSО4)2 + 2H2O
2Ва(OН)2 + H2SO4 = (BaOH)2SO4↓ + Н2O
Zn(OH)2 +2НCl = ZnCl2 + 2Н2O
2. Взаимодействие с основными и амфотерными оксидами
MgO + Н2SO4 = MgSO4 + Н2O
ZnO + 2НNO3 = Zn(NO3)2 + Н2O
CaO + Н3РO4 = CaHPO4↓ + H2O
3. Взаимодействие с металлами и неметаллами:
Мg + 2HC1 = MgC12 + Н2
Рb + ЗНС1 = Н[РbС13]+ H2
2Ag + 2H2SO4 (к) = Ag2SO4↓ + SO2 + 2H2O
3Р +5HMO3 +2H2O = 3H3PO4 + 5NO
3Si + 4HNO3 + 18HF = 3H2[SiF6] +4NO + 8H2O
4. Взаимодействие с солями:
Al(OН)2С1 + 2HCl = A1C13 +2H2O
Na3PO4 + НNO3 = Nа2НРO4+NaNO3
Na3PO4 + 2HNO3 = NаН2РO4 + 2NaNO3
Nа3РO4 + 3НNO3 = Н3РO4 + 3NaNO3
BaCl2+H2SO4 = BaSO4↓ + 2HCl
Na2CO3 + 2HCl = 2NaC1 + Н2O + CO2↑
Имейте в виду,что для протекания обменных реакций должно выполняться хотя бы одно из трех условий: образование осадка, газа или слабого электролита.
5. Разложение кислот:
4НNO3 = 2Н2O + 4NO2 + O2
Н2СO3 = Н2O + СO2
3Н3РO4 = Н3P3О9 + 3Н2O
2H3P3O9 = 3H2O + 3P2O5
2HClO2 = HClO3 + HClO
6. Взаимодействие с кислотами (малохарактерно):
3НС1 + НNO3 = NOC1 + Cl2 + 2Н2O
7. Взаимодействие с кислотными оксидами (малохарактерно):
6НС1O7 + 3Р2O5 = 2Н3Р3O9 + 3С12O7
Основаниями называются соединения, содержащие в качестве аниона только гидроксид ионов ОН-. Число гидроксид - ионов, способных замещаться кислотным остатком, определяет кислотность основания. В связи с этим основания бывают одно-, двух- и поликислотные, однако к истинным основаниям чаще всего относят одно- и двухкислотные. Среди них следует выделить растворимые и не растворимые в воде основания. Учтите, что растворимые в воде и диссоциирующие при этом практически нацело основания называют щелочами (сильные электролиты). К ним относятся гидроксиды щелочных и щелочноземельных элементов и ни в коем случае раствор аммиака в воде.
Название основания начинается со слова «гидроксид», после которого в родительном падеже приводится русское название катиона, а в круглых скобках указывается его заряд. Допускается перечисление количества гидроксид - ионов с помощью приставок ди-, три-, тетра. Например: Mn(OH)3 - гидроксид марганца (III) или тригидроксид марганца.
Обратите внимание на то, что между основаниями и основными оксидами существует генетическая связь: основным оксидам соответствуют основания. Поэтому катионы оснований чаще всего имеют заряд один или два, что соответствует низшим степеням окисления металлов.
Запомните основные способы получения оснований
1. Взаимодействие активных металлов с водой:
2Na + 2Н2О = 2NаОН + Н2 ↑
Lа + 6Н2О = 2Lа(ОН)3 + 3H2↑
2. Взаимодействие основных оксидов с водой:
СаО+Н2О = Са(ОН)2
МgО +Н2О = Мg(ОН)2.
3. Взаимодействие солей со щелочами:
МnSO4 + 2КОН = Mn(OH)2↓ + K2SО4
NH4С1 + NaOH = NaCl + NH3 +∙ H2O
Nа2СO3 + Са(ОН)2 = 2NаОН + CaCO3
MgOHCl + NaOH = Mg(OH)2 + NaCl.
4. Электролиз водных растворов солей с диафрагмой:
2NaCl + 2H2O → 2NaOH + Cl2 + Н2
Учтите, что в пункте 3 исходные реагенты необходимо подбирать таким образом, чтобы среди продуктов реакции было либо труднорастворимое соединение, либо слабый электролит.
Обратите внимание на то, что при рассмотрении химических свойств оснований условия проведения реакций зависят от растворимости основания.
1. Взаимодействие с кислотами:
NaOH + Н2SO4 = NaHSO4 + Н2O
2NaOH + Н2SO4 = Na2SO4 + 2Н2O
2Mg(OH)2 + H2SO4 = (MgOH)2SO4 + 2H2O
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
Mg(OH)2 + 2H2SO4 = Mg(HSO4)2 + 2H2O
2. Взаимодействие с кислотными оксидами:
NaOH + CO2 = NaHCO3
2NaOH + CO2 = Na2CO3 + H2O
Fe(OH)2 + P2O5 = Fe(PO3)2 + H2O
3Fе(OH)2 + P2O5 = Fe3(PO4)2 + 2H2O
3. Взаимодействие с амфотерными оксидами:
Al2O3 + 2NaOHp +3H2O = 2Na[Al(OH)4]
Al2O3 + 2NaOHт = 2NaAlO2 + H2O
Cr2O3 + Mg(OH)2 = Mg(CrO2)2 + H2O
4. Взаимодействие с амфотерными гидроксидами:
Са(ОН)2 + 2Al(ОН)3 = Ca(AlO2)2 + 4H2O
3NaOH + Cr(ОН)3 = Na3[Cr(OH)6]
5. Взаимодействие с солями.
К реакциям, описанным в пункте 3 способов получения, следует добавить:
2ZnSO4 + 2КОН = (ZnOH)2SO4 + K2SO4
NaHCO3 + NaOH = Na2CO3 + Н2O
BeSO4 + 4NaOH = Na2[Be(OH)4] + Na2SO4
Cu(OH)2 + 4NH3∙H2O = [Cu(NH3)4](OH)2 + 4H2O
6. Окисление до амфотерных гидроксидов или солей:
4Fe(ОН)2 + O2 + 2Н2O = 4Fe(OH)3
2Cr(ОН)2 + 2Н2O + Na2O2 + 4NaOH = 2Na3[Cr(OH)6]
7. Разложение при нагревании:
Са(OН)2 = СаО + Н2О
Учтите, что гидроксиды щелочных металлов, кроме лития, в таких реакциях не участвуют.
Промежуточное положение между основаниями и кислотами занимают амфотерные гидроксиды. Они проявляют слабовыраженные основные и кислотные свойства. Их классификация и номенклатура ничем не отличаются от оснований. При этом учитывается кислотность амфотерного гидроксида и заряд катиона, входящего в его состав.
Запомните основные способы получения амфотерных гидроксидов.
1. Взаимодействие солей со щелочами:
AlCl3 + 3NaOH = Al(OH)3¯ + 3NaCl
(AlOH)Cl2 + 2NaOH = Al(OH)3¯ + 2NaCl
2. Взаимодействие солей с кислотами:
Na2[Be(OH)4] + 2HCl = Be(OH)2↓+ 2NaCl+ 2H2О
3. Взаимный гидролиз солей:
3Na2CO3+2AlCl3 + 3H2О = 2Al(OH)3¯ + 3CO2↑+ 6NaCl
При рассмотрении химических свойств амфотерных гидроксидов следует учитывать их слабовыраженный основной и кислотный характер.
1. Взаимодействие с кислотами:
2Zn(OH)2 + H2SO4 = (ZnOH)2SO4 + 2H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Zn(OH)2 + 2H2SO4 = Zn(HSO4)2 + 2H2O
Cd((OH)2 + H2SiO3 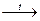 CdSiO3 + 2H2O
CdSiO3 + 2H2O
2. Взаимодействие с кислотными оксидами:
2Fe(OH)3 + 3SO3 = Fe2 (SO4)3 + 3H2O
Fe(OH)3 + SO3 = (FeOH) SO4 + H2O
3. Взаимодействие с основаниями:
Al(OH)3 + NaOHр. = Na[Al(OH)4]
Al(OH)3 + 3NaOHр. = Na3[Al(OH)6]
Zn(OH)2 + Mg(OH)2 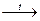 MgZnO2 + 2H2O
MgZnO2 + 2H2O
4. Взаимодействие с основными оксидами:
CaO + 2Fe(OH)3 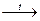 Ca(FeO2)2 + 3H2O
Ca(FeO2)2 + 3H2O
5. Разложение амфотерных гидроксидов:
Al(OH)3 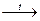 AlOOH + H2O
AlOOH + H2O
Zn(OH)2 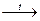 ZnO + H2O
ZnO + H2O
Соли являются наиболее многочисленной группой гетеросоединений. Соли - продукты полного или частичного замещения водорода кислоты катионами или гидроксид-ионов основания кислотным остатком. По своим свойствам и составу соли делятся на кислые - в состав аниона входят протоны, основные - в состав катиона входят гидроксид-ионы и средние - в состав соли не входят ни протоны, ни гидроксид-ионы. Обратите внимание на то, что кислые соли образуются при неполной нейтрализации кислоты, основные - основания или амфотерного гидроксида, а средние являются продуктом полной нейтрализации и кислоты, и гидроксида. Соли, в состав которых с одним кислотным остатком связаны несколько катионов, - двойные, а соли, в составе которых один катион связан с несколькими анионами, - смешанные. Если в состав катиона соли входит кислород, то они называются оксосолями и могут быть отнесены к основным. В состав кислотного остатка соли вместо кислорода может входить любая электроотрицательная частичка - гидроксосоли, тиосоли, цианосоли, фторосоли и т.д.
Название средних солей образуется из двух слов: международного наз-вания аниона в именительном падеже и катиона в родительном падеже с указанием его заряда. В названии кислых солей перед названием аниона используются приставки гидро-, дигидро-, тригидро-, тетрагидро- и т.д. В названии основных солей вначале ставятся приставки оксо-, гидроксо-, дигидроксо-, тригидроксо- и т.д. Например, Fе2(SO4)3 - сульфат железа (III), CrCl2 - хлорид хрома (II), Са3(PO4)2 - ортофосфат кальция, K3Р3O10 - триметафосфат калия, Мg(HSO4)2 - гидрофосфат магния, Nа2Н2РO4 - дигидрофосфат натрия, Al(ОН)2Cl - дигидроксохлорид алюминия, (FеОН)С12 - гидроксохлорид железа (II), Mg2OCl2 - оксохлорид магния, KAl(SO4)2 - сульфат калия-алюминия, Са(OСl)Сl - хлорид-гипохлорит кальция.
Запомните основные способы получения солей
1. Взаимодействие кислот с основными и амфотерными оксидами:
СаО + 2Н2SO4 = Сa(НSO4)2 + 2Н2O
СаО + Н2SO4 = СaSO4 + Н2O
Al2O3 + 2H3PO4 = 2AlPO4 + 3H2O
2. Взаимодействие кислотных и амфотерных оксидов с основаниями:
P2O5 + 6NаOН = 2Na3РO4 + ЗН2O
Р2O5 + 4NаОН = 2Na2HPO4 + H2О
Р2O5 + 2NaOH + H2O = 2NaH2PО4
2Mg(OH)2 + SO3 = (MgOH)2SO4 + H2O
ZnO + Ca(OH)2 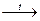 CaZnO2 + H2O
CaZnO2 + H2O
ZnO + 2NaOHp +H2O = Na2[Zn(OH)4]
3. Взаимодействие между оксидами:
3СаО + Р2O5 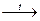 Са3(РO4)2
Са3(РO4)2
3Li2O + + 3P2O5 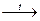 2Li3P3O9
2Li3P3O9
MgO + А12O3 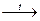 Mg(AlO2)2
Mg(AlO2)2
ZnO + SiO2 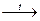 ZnSiO3
ZnSiO3
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами:
2Мg(OН)2 + Н2SO4 = (МgOН)2SO4 + 2Н2O
Mg(OH)2 + Н2SO4 = MgSO4 + 2Н2O
Mg(OH)2 + 2H2SО4 = Mg(HSO4)2 + 2Н2O
Al(OH)3 + Н3РO4 = А1РO4 + 3Н2O
5. Взаимодействие оснований с амфотерными гидроксидами:
Al(OH)3 + NaOHp = Na[Al(OH)4]
А1(OH)3 + 3NаОНр = Na3[Al(OH)6]
Fе(ОН)3 + 3КОН 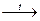 К3FеO3 + 3H2O
К3FеO3 + 3H2O
2Fе(OН)3 + Са(ОН)2 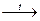 Са(FеO2)2 + 4Н2O
Са(FеO2)2 + 4Н2O
6. Взаимодействие солей с кислотами и основаниями:
CaSO4 + Н2SO4 = Cа(НSO4)2
MgSO4 + Mg(OH)2 = (MgOH)2SO4
7. Обменные реакции между солями:
Na2CO3 + ZnCl2 = ZnCO3↓ + 2NаС1
Са(НSO4)2 + (СаOН)2SO4 = 3CaSO4 +2Н2O
8. Взаимодействие cолей с оксидами:
Na2CO3 + SiO2 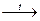 Na2SiO3 + СO2
Na2SiO3 + СO2
(NH4)2CO3 + MgO 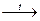 MgCO3 + 2NH3 + H2O
MgCO3 + 2NH3 + H2O
9. Взаимодействие металлов с кислотами и солями:
Zn + Н2SO4 = ZnSO4 + H2↑
CuSO4 + Cd = CdSO4 + Cu
Рb + 3H2SO4(k) = Рb(НSO4)2 + SO2 + 2H2O
10. Взаимодействие металлов и неметаллов со щелочами:
С12 + 2NaOHp = NaCl + NaOCl + H2O
Ве + 2КОНp + 2Н2O = K2 [Be(OH)4] + Н2
11. Разложение солей:
2NaHCO3 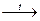 Na2CO3 + СO2 + H2O;
Na2CO3 + СO2 + H2O;
3NaH2PO4 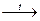 Na3P3O9 + 3H2O
Na3P3O9 + 3H2O
2Na2HPO4 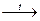 Na4P2O7 + H2O
Na4P2O7 + H2O
2KNO3 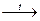 2KNO2 + O2
2KNO2 + O2
3NaClO = NaC1O3 + 2NaCl
2BiOH(NO3)2 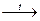 Bi2O(NO3)4 + H2O
Bi2O(NO3)4 + H2O
12. Получение двойных и смешанных солей:
Са(ОН)2 + С12 = Са(OС1)С1 + H2O
Н2SO4 + NaOH + КОН = NaKSO4 + 2H2O
Если вы внимательно изучили предыдущий материал, то большинство из химических свойств солей вам уже известно. Соли вступают в реакции взаимодействия с оксидами всех типов, основаниями, кислотами, амфотерными гидроксидами, металлами. Они могут реагировать между собой, разлагаться на новые соли или оксиды.
1. Подвергаться гидролизу:
Nа2СO3 + Н2O ↔NаHСO3 + NаОН
BiCl3 + Н2O ↔ ВiOНC12+ НCl
BiOHC12 + H2O ↔ Вi(OН)2C1 + HC1
Nа2НРO4 + Н2O ↔ NаН2РO4 + NaOH
Al2(СO3)3 + 3H2O ® 2А1(ОН)3↓ + 3CO2
2СuCO3 + Н2O ® (CuOH)2CO3↓+ СО2
2. Взаимодействовать с неметаллами:
2NaBr + С12 = 2NaCl + Вг2.
3. Реагировать между собой с образованием комплексных соединений:
KI + АgI = К[АgI2]
4КСN + Fe(СN)2 = К4 [Fе (CN) б]
Дата добавления: 2015-10-21; просмотров: 898;
