ЭЛЕКТРОФОРЕЗ
Электрофорез занимает сейчас центральное место среди мето-
дов исследования белков и нуклеиновых кислот. В современной
научной литературе редко можно встретить статью, в которой
бы на той или иной стадии фракционирования или характери-
стики этих биополимеров не был использован электрофорез. Ме-
тод позволяет разделять макромолекулы, различающиеся по та-
ким важнейшим параметрам, как размеры (или молекулярная
масса), пространственная конфигурация, вторичная структура
и электрический заряд, причем эти параметры могут выступать
как порознь, так и в совокупности.
Физический принцип метода заключается в следующем. На-
ходящиеся в буферном растворе макромолекулы обладают неко-
торым суммарным электрическим зарядом, величина и знак ко-
торого зависят от рН среды. Если через этот раствор, заключен-
ный в канал из изолирующего материала, например стеклянную
трубку, начать пропускать электрический ток, то вдоль канала
установится определенный градиент напряжения, т. е. сформи-
руется электрическое поле. Его напряженность измеряется раз-
ностью потенциалов по концам рабочего канала (или его уча-
стка), отнесенной к его длине (В/см). Под действием поля мак-
ромолекулы в соответствии со своим суммарным зарядом миг-
рируют в направлении катода или анода, причем их трение об
окружающую среду ограничивает скорость миграции. В зависи-
мости от величины заряда и размеров молекулы приобретают
разные скорости, и в этом — сущность процесса электрофореза.
Постепенно исходный препарат, состоявший из различных моле-
кул, разделяется на зоны одинаковых молекул, мигрирующих с
одной и той же скоростью. Со временем эти зоны распределя-
ются по длине канала (рис. 1, справа).
На рисунке, помимо рабочего канала (трубки), показаны не-
которые необходимые компоненты системы. Во-первых, это два
электрода, представленные спиральками из платиновой прово-
локи, а во-вторых, электродные резервуары. Через находящиеся
в них буферные растворы и рабочий канал замыкается электри-
ческая цепь между электродами.
Рабочий канал не случайно заштрихован. Дело не только в
том, что, будь он просто заполнен жидкостью, изображенная
Схема выглядела бы нелепо, так как буфер из трубки и верхнего
резервуара должен был вылиться в нижний. Эту трудность мож-
но обойти, если придать каналу с жидкостью U-образную фор-
му. Такие приборы использовались на первых этапах развития
метода (электрофорез в свободной жидкости). Хуже другое: в
жидкости нельзя избежать конвекции, которая деформирует и
смешивает разделяющиеся зоны. Поэтому в современных при-
борах рабочий канал заполняют гелем, что на схеме изобра-
жено штриховкой. Достаточно чи-
стая и хорошо смачиваемая (гид-
рофильная) пространственная
сетка геля удерживает жидкость
от вытекания и препятствует кон-
векции. Вместе с тем используе-
мые гели содержат очень много
жидкости (80—99,5%), в которой
(т. е. в рабочем буфере) и мигри-
руют макромолекулы. Наличие
сетки геля вносит важную допол-
нительную деталь в картину элек-
трофоретической миграции. Те-
перь фракционируемые макромо-
лекулы любых размеров неизбеж-
но сталкиваются с нитями поли-
мера, образующего сетку геля,
что увеличивает эффективное
трение о среду, а следовательно,
снижает скорость движения мо-
лекул. Очевидно, что препятствия
для миграции становятся особен-
но серьезными, если средний диаметр пространственных ячеек
геля оказывается соизмерим с размерами макромолекул. В этом
случае решающее влияние на электрофоретическую подвижность
различных макромолекул и степень разделения оказывает соот-
ношение их линейных размеров. Возможна даже такая ситуация,
когда особенно крупные молекулы белков или нуклеиновых кис-
лот вообще не смогут «протиснуться» через поры геля и их
миграция прекратится.
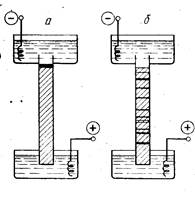
|
| Рис. 1. Схема простейшего прибо- ра для электрофореза в геле а — до начала фракционирования, б — после его окончания |
В настоящее время почти исключительно используются по-
лиакриламидные гели (ПААГ) и гели агарозы. Варьируя кон-
центрацию полимера, можно получать гели с очень широким
диапазоном размеров пор. Кроме того, можно изменять электри-
ческие заряды макромолекул путем вариации рН буфера, а их
конфигурацию путем введения в буфер денатурирующих аген-
тов или детергентов. Все это придает методу электрофореза ис-
ключительную гибкость.
Но есть, разумеется, и свои проблемы. Разделяемые макро-
молекулы все же находятся в растворе, поэтому возможна их
диффузия, приводящая к размыванию зон. Это тем более серь-
езно, что протекание через жидкость электрического тока неиз-
бежно связано с выделением тепла. К счастью, крупные моле-
кулы белков и нуклеиновых кислот диффундируют не слишком
быстро. Однако проблема теплоотвода и, главное, его равномер-
ности по всему гелю очень важна еще и потому, что скорость
миграции макромолекул в электрическом поле зависит от тем-
пературы. Неравномерность нагревания геля неизбежно приве-
дет к искажению зон и ухудшению их разделения.
В ходе электрофореза зоны растворенных макромолекул ос-
таются невидимыми. Для наблюдения за процессом в исходный
препарат добавляют краситель, молекулы которого несут элек-
трический заряд того же знака, что и фракционируемые макро-
молекулы, но не взаимодействуют с ними. Краситель тоже пере-
двигается в электрическом поле, но уже в виде окрашенной зо-
ны. Его подбирают таким образом, чтобы скорость миграции
наиболее подвижных макромолекул была несколько ниже, чем
у молекул красителя. Когда окрашенная зона доходит до конца
трубки, электрофорез прекращают.
Разделившиеся зоны биополимеров во избежание их диффу-
зии немедленно фиксируют. Для этого гель извлекают из стек-
лянной формы и вымачивают в смеси кислоты со спиртом так,
что белки или нуклеиновые кислоты выпадают в осадок в том
самом месте, где закончилась их миграция в ходе электрофоре-
за. После фиксации (или одновременно с ней) проводят окраши-
вание зон путем вымачивания геля в растворе красителя, прочно
связывающегося с белком или нуклеиновой кислотой. Излишек
красителя удаляют. На фотографии окрашенного цилиндриче-
ского ПААГ (рис. 2) хорошо видны четкие, узкие полосы раз-
делившихся компонентов исходной смеси белков.
Вместо цилиндрических часто используют гели в виде тонких
пластин, заполимеризованные между двумя плоскими стеклами.
Такие пластины имеют важное преимущество: на них можно
одновременно фракционировать несколько препаратов. Обычно
их вносят с одного края геля на равных расстояниях друг от
друга. Каждый препарат разделяется в электрическом поле не-
зависимо от своих соседей, образуя свой набор зон. На фото-
графии такой пластины (рис. 3) хорошо видна серия параллель-
ных «треков», исчерченных поперечными полосами окрашенных
зон, в которых располагаются (в данном случае) олигонуклео-
тиды различной длины.
Вместо окрашивания или наряду с ним часто используют ме-
тоды обнаружения разделенных зон по их радиоактивности.
К ним относятся приемы регистрации полос на фотопленке по-
средством авторадиографии или флюорографии и различные
способы счета радиоактивности в геле с помощью жидкостных
сцинтилляционных счетчиков.
Преимущества пластин не ограничиваются экономией вре-
мени и места при обработке большого количества препаратов.
Важнее другое: поскольку гель заливают в форму для полиме-
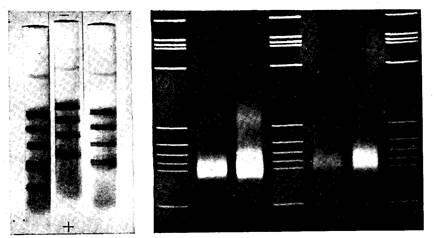
Рис. 2. Трубки с ПААГ после окончания электрофореза
Горизонтальные полоски — окрашенные белковые зоны
Рис. 3. Пластина агарозного геля после разделения фрагментов ДНК
Окраска люминесцентным красителем (бромистым этидием)
ризации жидким, то его концентрация, состав буфера и содер-
жание добавок строго одинаковы по всему сечению геля. Следо-
вательно, плотность тока и напряженность электрического поля
также одинаковы. Это обеспечивает строго идентичные условия
фракционирования разных препаратов и дает возможность до-
стоверного сопоставления их состава путем сравнения положе-
ния полос в параллельных треках. Если добавить к этому зна-
чительно более выгодные условия теплоотвода от тонкой пла-
стинки геля по сравнению с цилиндром, то станет понятной ис-
ключительная популярность этой системы электрофореза в по-
следние годы.
Фракционированием в ПААГ и агарозе не исчерпываются
современные методы электрофореза. В качестве «носителей»
жидкой фазышироко используют также пленки из ацетата цел-
люлозы, фильтровальную бумагу, тонкие слои силикагеля, цел-
люлозы, сефадекса и др. В некоторых случаях, например для
разделения низкомолекулярных веществ, эти системы имеют
свои преимущества, однако для фракционирования белков, ну-
клеиновых кислот и их фрагментов в настоящее время исполь-
зуют почти исключительно гель-электрофорез, поэтому только
он и будет подробно описан.
Рассмотрение начинается с характеристики исходных мате-
риалов и процессов их полимеризации. Затем, чтобы освобо-
дить дальнейшее изложение от повторений, будет описана тех-
ника приготовления гелей и соответствующая аппаратура. Гла-
ва 3 посвящена электрофорезу белков. После замечаний общего
характера будут подробно рассмотрены различные современные
приемы и варианты электрофореза. В отдельные разделы выне-
сены способы окрашивания, элюции из геля и регистрации ра-
диоактивности фракционированных белков, поскольку эти при-
емы в большинстве своем одинаковы для всех вариантов элек-
трофореза. Главу заключает описание способов препаративного
разделения белков. Такая же структура изложения принята для
рассмотрения электрофореза нуклеиновых кислот (глава 4). За-
мечания общего характера, изложенные в предыдущей главе, во
многом относятся к фракционированию обоих типов биополи-
меров, поэтому здесь будут рассмотрены только специфические
особенности электрофореза нуклеиновых кислот. В обеих по-
следних главах для иллюстрации различных эксперименталь-
ных приемов электрофоретического разделения биополимеров
разбираются многие новейшие работы. Разумеется, при этом
приводятся только наиболее существенные данные. Более де-
тальное описание следует искать в оригинальных публикациях,
на которые будут даны ссылки.
Глава 1
ГЕЛИ ДЛЯ ЭЛЕКТРОФОРЕЗА
ПОЛИАКРИЛАМИДНЫИ ГЕЛЬ (ПААГ)
Дата добавления: 2015-10-21; просмотров: 1533;
