Образование комплексных соединений
Образование комплексных соединений в реакциях обмена:
1) из растворов веществ:
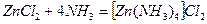 ;
;
2) из малорастворимых веществ
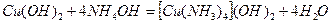
Действием избытка комплексообразующего реагента на катион комплексообразователя:
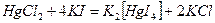 .
.
При взаимодействии щелочей с амфотерными основаниями образуются гидроксокомплексы:
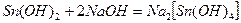
Для получения комплексных соединений часто используют реакции замещения:
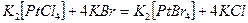
Порядок составления уравнений реакций комплексообразования на примере реакции:
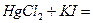
1) записать комплексообразователъ - 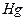 - и указать его степень окисления
- и указать его степень окисления 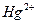 ;
;
2) приписать лиганды - ионы 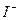 - из формулы другого вещества -
- из формулы другого вещества - 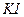 - в количестве, равном К.Ч. комплексообразователя
- в количестве, равном К.Ч. комплексообразователя
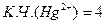 ;
;
3) заключив в квадратные скобки комплексообразователъ и лиганды 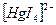 , определить заряд внутренней сферы комплексного соединения;
, определить заряд внутренней сферы комплексного соединения;
4) добавить ионы внешней сферы - ионы 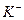 - с зарядом противоположным заряду внутренней сферы в количестве, нейтрализующим заряд внутренней сферы (сумма степеней окисления всех частиц соединения равна нулю) -
- с зарядом противоположным заряду внутренней сферы в количестве, нейтрализующим заряд внутренней сферы (сумма степеней окисления всех частиц соединения равна нулю) -  ;
;
5) написать формулу второго продукта реакции 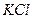 ;
;
6) расставить коэффициенты в уравнении реакции:
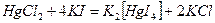 ;
;
7) ионное уравнение реакции образования тетраиодомеркурата (2) калия:
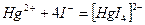 .
.
Константа равновесия реакции образования комплекса называется константой устойчивости 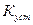 :
:



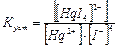 .
.
Константа устойчивости характеризует устойчивость комплекса: чем больше константа устойчивости, тем устойчивее комплекс.
4.6. Диссоциация комплексных соединений
Диссоциация комплексных соединений при их растворении в воде протекает в две стадии. На первой стадии комплексные кислоты, основания и соли как сильные электролиты полностью распадаются на ионы внутренней и внешней сферы:
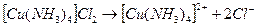
На второй стадии комплексные ионы (внутренняя координационная сфера) диссоциируют частично и обратимо по типу слабых электролитов. Число ступеней диссоциации равно координационному числу.
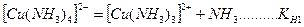
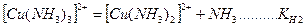
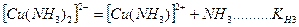
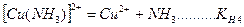 .
.
Каждой ступени диссоциации соответствует константа диссоциации, которая называется ступенчатой константой нестойкости. Произведение ступенчатых констант нестойкости также является константой и называется общей константой нестойкости:
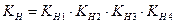
Для иона 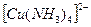 суммарное уравнение диссоциации:
суммарное уравнение диссоциации:
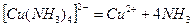
Общая константа нестойкости:
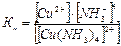 .
.
Константа нестойкости характеризует устойчивость комплексного иона: чем меньше константа нестойкости, тем прочнее комплексный ион.
Дата добавления: 2015-10-19; просмотров: 1448;
