Примеры решения задач. Пример 38. Определить заряд комплексного иона, координационное число и степень окисления комплексообразователя в соединении .
Пример 38. Определить заряд комплексного иона, координационное число и степень окисления комплексообразователя в соединении 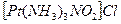 .
.
Решение. Внешняя сфера комплексного соединения 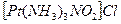 состоит из одного аниона
состоит из одного аниона 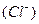 , следовательно, ее общий заряд составляет (1-). Отсюда следует, что заряд комплексного катиона равен (1+), т. е.
, следовательно, ее общий заряд составляет (1-). Отсюда следует, что заряд комплексного катиона равен (1+), т. е. 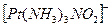 . Координационное число равно числу лигандов, т. е.
. Координационное число равно числу лигандов, т. е. 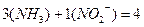 .
.
Степень окисления комплексообразователя определяется исходя из того, что сумма степеней окисления всех составных частиц комплексного иона равна его заряду. Заряд нейтральных молекул 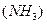 равен нулю, а заряд кислотного остатка
равен нулю, а заряд кислотного остатка 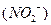 равен (1-). Обозначив степень окисления платины через х, приравняем сумму степеней окисления частиц заряду иона:
равен (1-). Обозначив степень окисления платины через х, приравняем сумму степеней окисления частиц заряду иона:
х + 3 ∙ 0 + 1 ∙ (1-) = (1-), откуда х = 2+.
Пример 39. Закончить уравнение реакции образования комплексной соли: 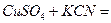 … Написать уравнение диссоциации соли и выражение константы нестойкости комплексного иона.
… Написать уравнение диссоциации соли и выражение константы нестойкости комплексного иона.
Решение: Комплексообразователем может служить ион меди (переходный элемент), его заряд равен 2+ (находим по формуле исходной соли).
Лигандами являются цианид - ионы 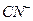 . Координационное число меди равно 4 (вдвое больше заряда комплексообразователя). Составляем внутреннюю сферу комплекса и определяем ее заряд:
. Координационное число меди равно 4 (вдвое больше заряда комплексообразователя). Составляем внутреннюю сферу комплекса и определяем ее заряд: 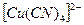 Внешней сферой должны быть положительные ионы, в данном случае – два иона калия, т.е.
Внешней сферой должны быть положительные ионы, в данном случае – два иона калия, т.е. 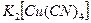 . Дописывая недостающий продукт, составляем уравнение реакции:
. Дописывая недостающий продукт, составляем уравнение реакции:
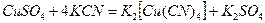
Растворимая комплексная соль, являясь сильным электролитом, в водном растворе диссоциирует необратимо на ионы внешней и внутренней сфер:
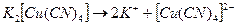
Комплексный ион диссоциирует обратимо и в незначительной степени на составляющие его частицы:
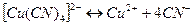 .
.
Константа нестойкости комплексного иона (Кн):
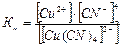 .
.
Пример 40. Определить ионный состав 0,1 М раствора комплексной соли 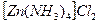 , если константа нестойкости комплексного иона равна 2,6 · 10 -10.
, если константа нестойкости комплексного иона равна 2,6 · 10 -10.
Решение:
1. Найдем концентрацию ионов внешней сферы. Для этого запишем уравнение реакции диссоциации комплексной соли:
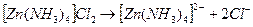
Из данного уравнения видно, что из 1 моль 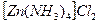 образуется 2 моль ионов
образуется 2 моль ионов 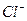 , тогда из 0,1 моль образуется
, тогда из 0,1 моль образуется 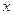 моль
моль 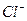 .
.
Отсюда 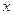 = 0,2 моль, т.е.
= 0,2 моль, т.е. 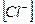 = 0,2 моль/л.
= 0,2 моль/л.
2. Найдем концентрацию комплексообразователя и лигандов. Предварительно рассчитаем концентрацию комплексных ионов, образующихся при диссоциации комплексной соли:
из 1 моль 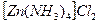 образуется 1 моль
образуется 1 моль 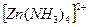 , тогда из 0,1 моль
, тогда из 0,1 моль 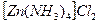 -
- 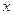 моль
моль 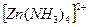 .
.
Отсюда 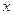 = 0,1 моль, т. е.
= 0,1 моль, т. е. 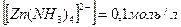 .
.
Комплексный ион диссоциирует:
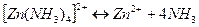
Пусть из 0,1 моль комплексных ионов образуется 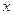 моль ионов
моль ионов 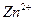 , тогда
, тогда 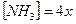 (так как молекул аммиака образуется в 4 раза больше, чем ионов цинка). Концентрация недиссоциированной части комплексного иона составит 0,1 моль/л.
(так как молекул аммиака образуется в 4 раза больше, чем ионов цинка). Концентрация недиссоциированной части комплексного иона составит 0,1 моль/л.
Запишем выражение константы нестойкости:
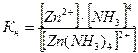
 .
.
Подставим в него цифровые данные и введенные обозначения:
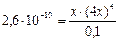 .
.
Решив уравнение относительно х, получим:
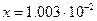 .
.
Следовательно: 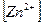 = 0,01 моль/л;
= 0,01 моль/л; 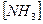 = 0,04 моль/л.
= 0,04 моль/л.
Дата добавления: 2015-10-19; просмотров: 2952;
