Основные положения координационной теории
Комплексные соединения имеют центральное строение. Центром любого комплексного соединения является центральный атом или комплексообразователь. Как правило, в роли центрального атома выступают катионы металлов, обычно
d–элементов, реже р–элементов.
Вокруг центрального атома-комплексообразователя - координированы анионы или нейтральные молекулы, которые называются лигандами: простые анионы: 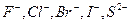 ; сложные анионы: циан-
; сложные анионы: циан- 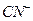 , тиоциан -
, тиоциан - 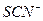 , нитрит -
, нитрит - 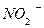 ,
,  оксалат -
оксалат - 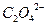 , карбонат -
, карбонат - 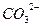 , сульфат -
, сульфат - 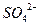 , тиосульфат -
, тиосульфат - 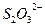 и др., нейтральные полярные молекулы аква-
и др., нейтральные полярные молекулы аква-  , аммин-
, аммин- 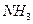 , гидразин-
, гидразин- 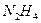 , пиридин -
, пиридин - 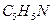 , этилендиамин (En) -
, этилендиамин (En) - 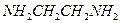 и др.
и др.
Количество связей, которые центральный атом может образовать с лигандами, называется координационным числом (к.ч.). Наиболее часто встречающиеся значения координационных чисел для некоторых комплексообразователей:
к.ч. = 6 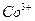
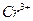
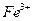

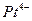
к.ч. = 4 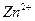
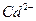
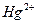
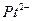
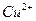
к.ч. = 2 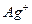
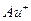
Центральный атом вместе с лигандами образуют внутреннюю координационную сферу комплексного соединения, которая заключается в квадратные скобки. Заряд внутренней сферы равен алгебраической сумме зарядов комплексообразователя и всех лигандов.
Ионы, которые не входят в состав внутренней сферы, образуют внешнюю координационную сферу. Заряд внешней координационной сферы или комплексного иона нейтрализует заряд внутренней сферы.
Число связей, которые образует лиганд с комплексообразователем, называется дентатностью. Если лиганд образует одну связь с центральным атомом, то он называется монодентатным (однозарядные анионы и нейтральные молекулы). Если лиганд образует несколько связей – то полидентатным (например, дидентатные 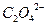 ,
, 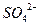 ).
).
Во внутренней сфере сначала пишут комплексообразователь, затем нейтральные лиганды - молекулы, затем отрицательные лиганды - анионы.
Например, в молекуле 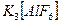 :
:
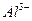 - комплексообразователь;
- комплексообразователь;
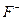 - лиганды,
- лиганды,
6 – координационное число;
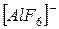 - внутренняя сфера;
- внутренняя сфера;
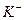 - ионы внешней сферы.
- ионы внешней сферы.
Дата добавления: 2015-10-19; просмотров: 802;
