Строение ферментов
Участок молекулы фермента, на котором происходит катализ, получил название активный центр. Если фермент по строению является простым белком, то его активный центр формируется только остатками аминокислот, которые обычно находятся в разных участках одной и той же полипептидной цепи или же в разных полипептидах, но пространственно сближены. Другими словами активный центр образуется на уровне третичной структуры белка-фермента. У ферментов - сложных белков в состав активного центра часто входит их простетическая группа.
Образование активного центра из функциональных групп, довольно далеко отстоящих друг от друга в полипептидных цепях, но совмещенных пространственно в активном центре (т.е. на уровне третичной структуры белка), позволяет ферменту за счет конформационных изменений обеспечивать необходимое соответствие между активным центром и молекулами реагирующих веществ (их обычно называют субстратами). Благодаря изменению конформации фермента происходит как бы «приспособление», «подгонка» активного центра к структуре молекул, превращения которых ускоряется данным ферментом.
Изменение конформации молекулы фермента является также одним из механизмов регуляции скорости ферментативных реакций (см. ниже).
В активном центре обычно выделяют два участка – адсорбционный и каталитический.
Адсорбционный участок (центр связывания) по своему строению соответствует структуре реагирующих соединений, и поэтому к нему легко присоединяются молекулы субстрата.
Каталитическийучасток активного центра непосредственно осуществляет ферментативную реакцию.
Большинство ферментов содержат в своей молекуле только один активный центр. У некоторых ферментов может иметься несколько активных центров.
8.2.Механизм действия ферментов
В любом катализе, осуществляемым ферментами, можно обнаружить три обязательные стадии.
На первой стадии молекулы реагирующих веществ (субстрата) присоединяются к адсорбционному участку активного центра фермента за счет слабых связей. Образуется фермент-субстратный комплекс, который может легко распадаться снова на фермент и субстрат, т.е. первая стадия ферментативного катализа полностью обратима. На этой стадии с помощью активного центра возникает благоприятная ориентация реагирующих молекул, что способствует их дальнейшему взаимодействию.
На второй стадии с участием каталитического участка активного центра и молекул субстрата происходят различные реакции, характеризующиеся низкой величиной энергии активации и поэтому протекающие с высокой скоростью. В результате этих реакций в конечном итоге образуется либо продукт реакции, или же почти готовый продукт.
На третьей стадии происходит отделение продукта реакции от активного центра с образованием свободного фермента, способного присоединять к себе новые молекулы субстрата. Если на второй стадии был получен почти готовый продукт, то он предварительно превращается в продукт, который затем отделяется от фермента.
Схематично стадии ферментативного катализа можно представить следующим образом:
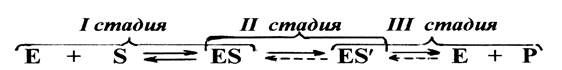 |
Фермент Субстрат Фермент- Химически- Продукт
субстратный преобразованный
комплекс фермент-субстрат-
ный комплекс (S¢ - продукт
или почти готовый продукт)
В клетках ферменты, катализирующие многостадийные химические процессы, часто объединяются в комплексы, называемые мультиферментными системами. Эти комплексы структурно связаны с органоидами клеток или же встроены в биомембраны. Объединение отдельных ферментов в единый комплекс позволяет одновременно ускорять все последовательные стадии превращения какого-либо субстрата.
В некоторых случаях в катализе наряду с белком-ферментом еще участвует низкомолекулярное (небелковое) соединение, называемое коферментом. Большинство коферментов в своем составе содержат витамины. Строение и механизм действия коферментов будут рассмотрены при описании химических реакций, в которых они принимают участие.
8.3. Специфичность ферментов.
Различают два вида специфичности ферментов: специфичность действия и субстратная специфичность.
Специфичность действия –это способность фермента катализировать только строго определенный тип химической реакции. Если субстрат может вступать в разные реакции, то для каждой реакции нужен свой фермент. Например, широко распространенный в клетках глюкозо-6-фосфат (производное глюкозы) подвергается различным превращениям:
 Глюкоза + фосфорная кислота
Глюкоза + фосфорная кислота

 Глюкозо-6-фосфат Глюкозо-1-фосфат
Глюкозо-6-фосфат Глюкозо-1-фосфат
Фруктозо-6-фосфат
Отщепление от этого субстрата фосфорной кислоты происходит под действием фермента фосфатазы. При этом фосфатаза катализирует только реакцию отщепления фосфорной кислоты, никакие другие превращения глюкозо-6-фосфата этот фермент не ускоряет. Другое возможное превращение глюкозо-6-фосфата осуществляется с участием фермента мутазы. В этом случае глюкозо-6-фосфат переходит в глюкозо-1-фосфат. Еще один фермент – изомераза вызывает превращение глюкозо-6-фосфата во фруктозо-6-фосфат.
Таким образом, каждый фермент катализирует только одну из всех возможных реакций, в которые может ступать субстрат. Специфичность действия определяется в основном особенностями строения каталитического участка активного центра фермента.
Субстратная специфичность – способность фермента действовать только на определенные субстраты.
Различают две разновидности субстратной специфичности: абсолютную и относительную.
Фермент, обладающий абсолютной субстратной специфичностью, катализирует превращения только одного субстрата. На другие вещества, даже очень близкие по строению к этому субстрату, фермент не действует. Примером фермента с абсолютной субстратной специфичностью является аргиназа – фермент, отщепляющий от аминокислоты аргинина мочевину. Аргинин – единственный субстрат аргиназы.
Относительная (групповая) субстратная специфичность – это способность фермента катализировать превращения нескольких похожих по строению веществ. Обычно эти вещества обладают одним и тем же типом химической связи и одинаковой структурой одной из химических группировок, соединенных этой связью. Например, фермент пепсин расщепляет пептидные связи в белках любого строения.
Субстратная специфичность обусловлена, главным образом, структурой адсорбционного участка активного центра фермента.
Дата добавления: 2015-10-19; просмотров: 1949;
