Реакция вытеснения кислотной формы
Основана на вытеснении слабой органической кислоты из её соли сильной минеральной кислотой. Используется в фармакопейном анализе для идентификации натриевых солей барбитуратов (барбитал-натрий, этаминал-натрий, гексенал). Выделяющиеся органические кислоты отделяют, высушивают и определяют температуру плавления.
 Т°пл
Т°пл
ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА, В СТРУКТУРЕ КОТОРЫХ ПРИСУТСТВУЮТ КОВАЛЕНТНО СВЯЗАННЫЕ ГАЛОГЕНЫ
Ковалентно связанный галоген – это галоген, входящий в структуру молекулы органического вещества и связанный ковалентной связью с атомом углерода.
По природе галогена различают:
· Фтор – фторотан, фторурацил
· Хлор – хлорэтил, хлорамин Б,
· Бром – бромкамфора
· Йод –дийодтирозин, тиреоидин, трийодтиронин.
Поскольку галогены с органической частью молекулы связаны не ионогенно, их непосредственное определение в таких соединениях невозможно. Для доказательства галогена необходимо разрушить его связь с углеродом и перевести в ионогенное состояние.
Этот процесс может осуществляться несколькими способами.
1. гидролитическое разложение водным (бромизовал) или спиртовым (хлорэтил) раствором щелочи
2. восстановительная минерализация водородом в момент его выделения (металлический цинк в щелочной среде, цинк в уксусной кислоте) – бромкамфора
3. сжигание в колбе с кислородом (для всех)
4. прокаливание со смесью для спекания (все, кроме фторсодержащих)
5. проба Бельштейна
6. специальные способы для йодсодержащих (нагревание в сухой пробирке, действие концентрированных кислот)
Выбор способа переведения ковалентно связанного галогена в ионогенное состояние определяется прочностью связи углерод – галоген (она падает от фтора к йоду), а также строением галогенсодержащего ЛВ. Способы переведения галогена в ионогенное состояние отличаются по степени жесткости условий.
- Гидролитическое разложение
для ЛВ, содержащих галоген в алифатической цепи (кроме фтора) водным или спиртовым раствором гидроксида натрия при нагревании:

хлорэтил
- Восстановительная минерализация водородом в момент его выделения– для алифатических, алициклицеских, ароматических и гетероциклических ЛВ, содержащих хлор, бром, йод (кроме фтора). Восстановители: металлический цинк в щелочной среде Zn + NaOH (бромкамфора) или металлический цинк в уксусной кислоте Zn + CH3COOH.
Zn + 2NaOH → Na2ZnO2 + 2H↑
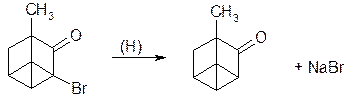
бромкамфора
Вследствие высокой прочности связи углерод-фтор, фторсодержащие соединения минерализуют действием сильного восстановителя – нагреванием с расплавленным металлическим натрием (фторотан).
- Метод сжигания в колбе с кислородом (ГФ XI, ГФ XII) основан на разрушении вещества сжиганием в колбе, наполненной кислородом (для всех галогенсодержащих соединений).
Эффективен и универсален, поэтому может использоваться как для качественного, так и количественно определения. Продукты сгорания растворяют в соответствующем растворителе – поглощающей жидкости и анализируются на наличие соответствующего галогенида.
- Проба Бельштейна – основана на образовании летучих галогенидов меди, окрашивающих пламя горелки в зеленый (йод) или голубовато-зеленый (хлор, бром) цвет. Препарат на медной проволоке вносят в пламя.
2Cu + Hal2 → 2CuHal
Проба очень чувствительна, но не позволяет определить природу галогена и анализировать фторсодержащие ЛВ, т. к. фторид меди нелетуч.
- Прокаливание со смесью для спекания карбонаты натрия и калия, либо нитрат калия и карбонат натрия (все, кроме фторсодержащих)
- Специальные способы для йодсодержащихЛВ
ü нагревание в сухой пробирке
ü действие концентрированных кислот.
Эффект – выделение фиолетовых паров йода.
Образующиеся галогенид-ионы доказывают реакциями:
Хлорид-ион открывают по реакции осаждения нитратом серебра в азотнокислой среде. Образуется белый творожистый осадок, растворимый в растворе аммиака и нерастворимый в азотной кислоте.

Бромид-ион открывают с нитратом серебра в азотнокислой среде.
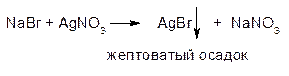
Осадок трудно растворим в растворе аммиака и нерастворим в азотной кислоте разведенной.
или по реакции окисления до брома с хлорамином в кислой среде. Выделяющийся бром извлекают хлороформом, слой хлороформа окрашивается в желто-бурый цвет.
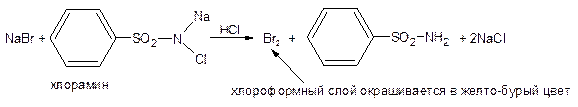
Реакция идет в 2 стадии
1 стадия
СНСI3
2 стадия 2Br - + CL2 → Br2 + 2CL –
Йодид-ион открывают с нитратом серебра в азотнокислой среде. Образуется желтый творожистый осадок, не растворимый в растворе аммиака и нерастворимый в азотной кислоте.
или по реакции окисления до йода в кислой среде с нитритом натрия или хлоридом железа (III). Йод окрашивает хлороформ в розовый или фиолетовый цвет.
(H2SO4)
2NaI + 2FeCI3 → I2 + 2FeCI2 + 2NaCI
2KI + 2NaNO2 + 2H2SO4 → I2 + K2SO4 + Na2SO4 + 2NO↑ + 2H2O
Фторид-ион доказывают косвенным путём по разрушению цирконийализаринового красителя вследствие связывания в более прочный комплекс с фторидом. При этом окраска раствора изменяется от красно-фиолетовой до жёлтой. Способ используется для обнаружения фтора во фторотане, фторафуре, фторурациле.
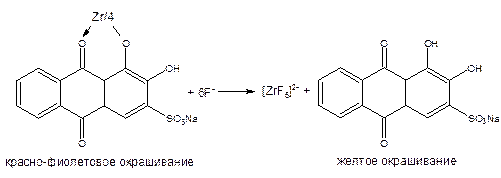
ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА, СОДЕРЖАЩИЕ КОВАЛЕНТНО СВЯЗАННУЮ СЕРУ
Это сера, входящая в структуру лекарственного вещества и связанная ковалентной связью с атомом углерода.
Идентификация серосодержащих соединений основана на предварительной минерализации до неорганического серосодержащего иона, который доказывают известными реакциями. Минерализацию серы в составе органического соединения осуществляют путём окисления до сульфата (окислительная минерализация) или восстановлением до сульфида (восстановительная минерализация).
1. Окислительную минерализацию проводят путём нагревания сухого вещества с концентрированной азотной кислотой (дихлотиазид) или сплавлением с окислительной смесью: нитрат + карбонат калия (бутамид). В процессе минерализации органическая часть молекулы окисляется до воды и углекислоты, а ковалентно связанная сера образует сульфат-ион (серную кислоту или её соли), который доказывают по реакции:
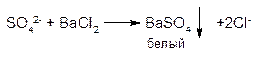
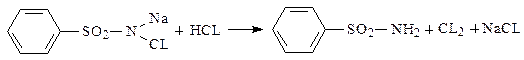
2. При восстановительной минерализации лекарственное вещество сплавляют с едким натром или нагревают с 10% его раствором. Ковалентно связанная сера образует сульфид, который доказывают по запаху (норсульфазол) или после подкисления по потемнению фильтровальной бумаги, смоченной ацетатом свинца.
Pb(CH3COO)2 + Na2S  PbS↓ + 2CH3COOH
PbS↓ + 2CH3COOH
Особенностью ковалентно связанной серы в структуре производных фенотиазина и антибиотиков цефалоспоринового ряда является её лёгкая окисляемость. При этом образуются продукты окисления, окраска которых зависит от строения анализируемого соединения. В качестве окислителей используют хлорид железа, пероксид водорода, калия бромат, азотную или серную кислоты, бромную воду.
Например, аминазин при окислении бромной водой даёт малиновое окрашивание, этмозин – ярко-фиолетовое.

Дата добавления: 2015-09-07; просмотров: 6889;
