Спектри випромінювання воднеподібних атомів. Формула Бальмера – Рідберга
Для визначення частот 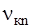 спектральних ліній випромінювання воднеподібних атомів звернімося до рівняння частот (див. другий постулат). Підставимо в (1) замість величин Ек та Еn їхні значення згідно (6). Одержимо:
спектральних ліній випромінювання воднеподібних атомів звернімося до рівняння частот (див. другий постулат). Підставимо в (1) замість величин Ек та Еn їхні значення згідно (6). Одержимо:
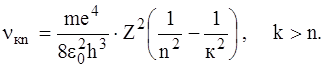
Скориставшись співвідношенням 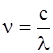 між частотою та довжиною хвилі (с – швидкість світла у вакуумі), останню формулу можна перетворити до вигляду:
між частотою та довжиною хвилі (с – швидкість світла у вакуумі), останню формулу можна перетворити до вигляду:
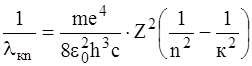
або
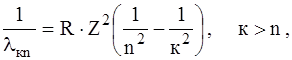 (7)
(7)
де
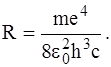 (8)
(8)
Величина R називається сталою Рідберга (R = 1,097· 107 м–1).
Формула (7), одержана Бором теоретично, була встановлена експериментально у 1885 р. за результатами спектральних вимірювань і відома як формула Бальмера – Рідберга.
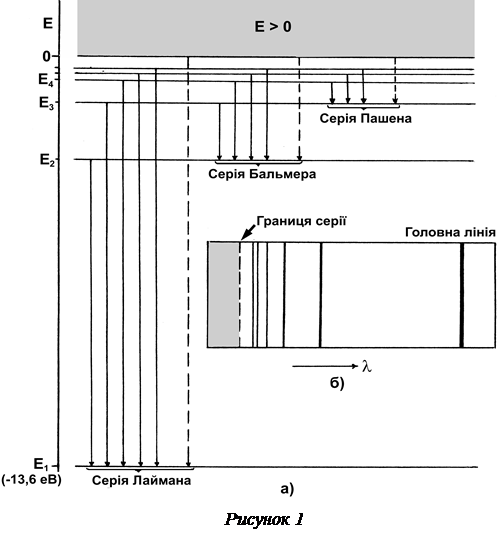
Для з’ясування деяких важливих понять, які використовуються при обговоренні атомних спектрів випромінювання, розглянемо діаграму енергетичних рівнів атома водню (рисунок 1, а). Дискретні значення енергії атома Е1, Е2, … показані на схемі горизонтальними лініями. Згідно (5) та (6), чим більше n, тим далі від ядра знаходиться електрон і тим вище лежить відповідний рівень енергії на діаграмі. Загалом в атомі існує нескінченна кількість можливих стаціонарних станів між основним рівнем Е1 = –13,6 еВ і рівнем Е∞ = 0, який відповідає стану іонізації атома водню (при n радіус rn ). Енергію іонізації водню Еі, тобто мінімальну енергію, потрібну для вилучення електрона з атома водню, який перебував в основному стані, легко знайти:
 Еі = Е – Е1; Еі = – Е1 = 13,6 еВ.
Еі = Е – Е1; Еі = – Е1 = 13,6 еВ.
Область енергій Е < 0 на діаграмі відповідає електрону, який знаходиться на одній з стаціонарних орбіт в атомі, тобто перебуває у зв’язаному стані. В цій області енергія електрона змінюється дискретно. В області енергій Е > 0 електрон втрачає зв’язок з ядром атома, стає вільним електроном, і його енергія може набувати довільних значень.
При відсутності зовнішніх впливіватом перебуває в основному стані. Всі енергетичні рівні атома, крім основного, називаються збудженими, оскільки для переходу на них атому необхідно надати певну енергію = Еn – Е1 – енергію збудження. Таку енергію атом може одержати, поглинувши квант випромінювання відповідної частоти від зовнішнього джерела (радіаційне збудження), або внаслідок непружного зіткнення з іншим атомом або електроном (збудження ударом). Час існування атома в збуджених станах (час життя) t ~ 10–8 с, після чого атом сам собою (спонтанно) переходить на один з розташованих нижче енергетичних рівнів, висвітлюючи квант випромінювання, частота якого, згідно (7), залежить від номерів к та n верхнього та нижнього рівнів.
Спектр атома водню поділяється на відокремлені групи спектральних ліній, які мають схожий вигляд, але розташовані в різних областях довжин хвиль. Такі групи називають спектральними серіями. В спектрі випромінювання лінії даної спектральної серії виникають при всіх квантових переходах з різних початкових збуджених рівнів на один, спільний, кінцевий рівень і “сходяться” до границі серії, яка має мінімальну для даної серії довжину хвилі (рисунок 1, б). Кожна серія починається з головної лінії – першої і найбільш яскравої спектральної лінії в даній серії. Перші три серії спектра водню такі:
Серія Лаймана була відкрита у 1906 р. в ультрафіолетовій області спектра. Спектральні лінії серії Лаймана виникають при переходах атома з будь-яких збуджених станів у основний стан. У формулі (7) цим переходам відповідають значення n = 1 та к = 2, 3, …
Серія Бальмера відкрита першою у 1885 р. Утворена переходами атома на перший збуджений енергетичний рівень n = 2 з усіх розташованих вище рівнів (к = 3, 4, …). Серія Бальмера починається у видимій області і закінчується у ближній ультрафіолетовій області
Серія Пашена (n = 3, к = 4, 5, …) відкрита у 1908 р. і лежить у інфрачервоній області спектра.
Для спектральних вимірювань в даній роботі використовується призмовий спектроскоп. Основним елементом спектроскопа є скляна тригранна призма, яка розкладає досліджуване випромінювання у спектр. Джерело досліджуваного випромінювання розміщується перед вхідною щілиною об’єктива коліматора – оптичної системи для створення паралельного пучка променів. Проходячи крізь призму, промені внаслідок дисперсії відхиляються на той чи інший кут в залежності від довжини хвилі. Спостереження ведуть через окуляр зорової труби. В спектроскопах з великою дисперсією досліджуване випромінювання розгортається призмою у великому інтервалі кутів, тому в полі зору окуляра можна спостерігати лише ту чи іншу ділянку спектра. В таких випадках конструкція спектроскопа передбачає можливість плавним поворотом призми переміщувати зображення спектра в полі зору окуляра. Поворот призми здійснюється за допомогою рукоятки барабана, оздобленого шкалою.
Перш ніж починати спектральні вимірювання, кожний спектроскоп необхідно проградуювати, тобто встановити залежність показів шкали барабана даного спектроскопа від довжини хвилі випромінювання: N = N(λ). Таку залежність звичайно подають у графічній формі і називають дисперсійною кривою. На практиці дисперсійну криву приладу можна побудувати, виконавши попередні вимірювання будь-якого відомого лінійчатого спектра, який містить достатню кількість яскравих спектральних ліній у видимій області. Зручним для градуювання є, наприклад, спектр випромінювання атомів ртуті, який і використовується в даній роботі.
Спектр випромінювання ртуті одержують з допомогою ртутно-кварцової лампи ДРТ-200 (дугова ртутна трубка потужністю 200 Вт). Кварцова трубка лампи заповнена аргоном до тиску в кілька мм. рт. ст.; кількість рідкої ртуті дозована таким чином, щоб при робочій температурі уся ртуть випаровувалася і при цьому створювався тиск парів 1 – 1,2 атм. При подачі напруги в лампі виникає електричний (дуговий) розряд, в якому починається процес збудження атомів ртуті електронними ударами. Під час роботи кварцова трубка нагрівається до 700 – 750 К, а температура розряду в лампі сягає 6000 – 6500 К. Випромінювання лампи містить ряд інтенсивних ультрафіолетових та видимих ліній (таблиця 1). Для захисту очей від шкідливої дії ультрафіолетового випромінювання лампу розміщують в металевому екрані.
Таблиця 1. Довжини хвиль яскравих ліній в спектрі ртутної лампи ДРТ-200
| Колір лінії | Відносна яскравість (візуальна оцінка) | Довжина хвилі, нм |
| Жовтогаряча Жовта Жовта Зелена Блакитна Синя Фіолетова Фіолетова | < 1 | 612,4 579,1 577,0 546,1 491,6 435,8 407,8 404,8 |
При дослідженнях спектра водню у видимій області джерелом світла служить воднева трубка. Трубку (скляну або кварцову) заповнюють воднем до тиску 5…10 мм. рт. ст. і герметизують. З обох кінців у трубку введені електроди, до яких через зовнішні контакти підводять високу напругу від котушки Румкорфа – багатовиткової індукційної котушки, в якій при періодичних перериваннях електричного струму виникає ерс самоіндукції ~ 10…15 кВ. В середній частині водневої трубки її внутрішній діаметр дуже малий (капіляр), і при виникненні електричного розряду ця частина трубки світиться найбільш яскраво.
ВИЗНАЧЕННЯ ПЕРІОДУ НАПІВРОЗПАДУ
РАДІОАКТИВНОГО ІЗОТОПУ.
ВИЗНАЧЕННЯ КОЕФІЦІЄНТА ПОГЛИНАННЯ
РАДІОАКТИВНОГО ВИПРОМІНЮВАННЯ МАТЕРІАЛАМИ
Будь-яке атомне ядро складається з протонів та нейтронів, зв’язаних між собою ядерними силами (сильна взаємодія). Загальна назва цих частинок – нуклони.
Протон(р)–позитивно заряджена частинка з зарядом, рівним елементарному заряду е. Маса протона mр = 1836,26 mе майже у 2000 разів перевищує масу електрона mе. Спін протона дорівнює ½.
Нейтрон(n) – електрично нейтральна частинка. Маса нейтрона mn близька до маси протона: mn = 1838,68 mе. Спін нейтрона дорівнює ½.
У вільному стані протон – стабільна частинка, а нейтрон –нестабільний і самодовільно розпадається, перетворюючись у протон, електрон та антинейтрино.
Основні величини, які характеризують склад ядра, – зарядове число Z та масове число А. Зарядове число Z (атомний номер) співпадає з кількістю протонів у ядрі і визначає заряд ядра: +Ze. Масове число А дорівнює сумарній кількості нуклонів у ядрі і приблизно відповідає масі ядра в атомних одиницях маси (1 а. о. м. = 1,66· 10–27 кг). Різниця цих чисел дає кількість нейтронів у ядрі: N = A – Z.
Розглянуті характеристики ядра відображені в символічному позначенні 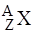 , де під Х розуміють хімічний символ елемента, атому котрого належить дане ядро (наприклад,
, де під Х розуміють хімічний символ елемента, атому котрого належить дане ядро (наприклад, 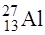 ). Оскільки заряд ядра +Zе визначається місцем елемента в періодичній системі Менделєєва, число Z в символічному позначенні можна не вказувати (наприклад,
). Оскільки заряд ядра +Zе визначається місцем елемента в періодичній системі Менделєєва, число Z в символічному позначенні можна не вказувати (наприклад, 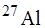 ).
).
Ядра з однаковим Z, але різними А, тобто різними числами нейтронів, називають ізотопами (від грец. ϊσος– рівний, однаковий; τόπος – місце).
Більшість елементів мають декілька ізотопів, наприклад, у простішого з елементів – водню – три ізотопи:  - протій,
- протій, 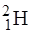 - дейтерій,
- дейтерій,  - тритій. Хімічні властивості ізотопів даного елемента однакові, проте фізичні властивості їхніх ядер суттєво відрізняються. Загальна кількість відомих ізотопів складає близько 280 стабільних та більше 2000 нестабільних (радіоактивних).
- тритій. Хімічні властивості ізотопів даного елемента однакові, проте фізичні властивості їхніх ядер суттєво відрізняються. Загальна кількість відомих ізотопів складає близько 280 стабільних та більше 2000 нестабільних (радіоактивних).
Дата добавления: 2015-10-06; просмотров: 2804;
