Третий закон термодинамики. Определяя энтропии веществ при разных температурах В.Нернст (1906 г.) установил, что в процессах, протекающих при температурах
Определяя энтропии веществ при разных температурах В.Нернст (1906 г.) установил, что в процессах, протекающих при температурах, близких к абсолют-ному нулю, энтропия мало меняется. На этой основе возник III закон термодинамики: «энтропия абсолютно чистого вещества при температуре абсолютного нуля равна нулю». Отсюда вытекает, что Sкр. < Sж < Sгаз.
| По мере увеличения температуры энтропия будет возрастать. При фазовых превращениях она меняется скачкообразно. Она возрастает и при добавлении другого вещества или при деформации структуры. Увеличение энтропии характерно для многих реакций разложения, для фазовых переходов «твердое тело ® жидкость», «жидкость ® газ». Энтропия уменьшается в ходе многих реакций соединения, при фазовых переходах «газ ® жидкость», «жидкость® твердое тело». | 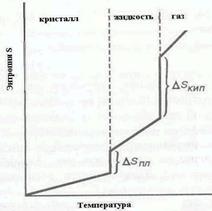 Рис.7. Зависимость энтропии от
температуры
Рис.7. Зависимость энтропии от
температуры
|
Дата добавления: 2015-10-05; просмотров: 1669;
