в открытых и закрытых системах
Разность значений функций Н – TS называют энергией Гиббса или свободной энергией при изобарных условиях. Энергия Гиббса – это часть энтальпии, за счёт которой может совершаться работа при постоянной температуре. Так как энергия Гиббса является функцией состояния, можно судить только об её изменении:
DG = DH – TDS
В случае изобарно-изотермических процессов самопроизвольно протекают те процессы, в ходе которых свободная энергия Гиббса уменьшается, т.е. когда DG<0.
Энергия Гиббса также зависит от количества вещества и поэтому является изобарно-изотермическим потенциалом ( 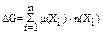 ) и служит критерием самопроизвольности изобарных процессов.
) и служит критерием самопроизвольности изобарных процессов.
Уравнение DG = DH – TDS является выражением второго закона термодина-мики. Из него следует, что самопроизвольное течение реакции определяется энтальпийным (DH) и энтропийным (TDS) факторами. Для реакций, у которых DH< 0, DS > 0, энергия Гиббса убывает (DG < 0), т.е. такие реакции могут проте-кать самопроизвольно при любых температурах. Если DH > 0, DS < 0 самопроиз-вольное течение реакции невозможно, т.к. оба фактора препятствуют течению реакции и DG > 0. В случае, когда DH > 0, DS > 0, самопроизвольному протеканию реакции способствует энтропийный фактор. Реакция возможна при больших температурах, т.е. когда |DH| <|TDS|. В случае, если DH < 0, DS < 0, то самопроиз-
вольному протеканию реакции способствует энтальпийный фактор. Реакция возможна при низких температурах, т.е. когда |DH| > |TDS|.
Используя уравнения Гиббса можно определить условия протекания прямой и обратной реакции, условия равновесия. Константа равновесия, ЭДС окислительно-восстановительных реакций связаны с энергией Гиббса следующими уравнениями: DG = - RTlnKp и DG = - nFЕэ. Если известна константа равновесия реакции или разность окислительно-восстановительных потенциалов, то можно рассчитать энергию Гиббса и наоборот, если известна энергия Гиббса реакции при заданных концентрациях, можно рассчитать константу равновесия: 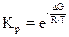 . Если для реакции Кр > 1, то DG < 0, т.е реакция идет в прямом направлении; в случае, когда Kp < 1, DG > 0, протекает обратная реакция. Когда Кр = 1, DG = 0 (система находится в равновесном состоянии).
. Если для реакции Кр > 1, то DG < 0, т.е реакция идет в прямом направлении; в случае, когда Kp < 1, DG > 0, протекает обратная реакция. Когда Кр = 1, DG = 0 (система находится в равновесном состоянии).
Дата добавления: 2015-10-05; просмотров: 1105;
