Термохимия
Термохимия – раздел химической термодинамики, изучающий тепловые эффекты химических реакций. Теплота (тепловой эффект) химической реакции – это максимальное количество теплоты, которое выделяется или поглощается в необратимом процессе при отсутствии полезной работы и при одинаковой температуре исходных и конечных продуктов.
Термохимическое уравнение – это уравнение химической реакции, содержащее указания о теплоте реакции и об агрегатном состоянии участников реакции. С термохимическими уравнениями можно проводить такие же математические операции, как и с алгебраическими.
Расчет теплоты химической реакции значительно упрощается, если восполь-зоваться следствиями из закона Гесса.
В основе термохимии лежит закон Гесса (1842 г.): теплота (тепловой эффект) реакции не зависит от пути реакции (т.е. наличия промежуточных стадий), а определяется лишь начальным и конечным состояниями (природой веществ) системы. Например,
С DН1 СО
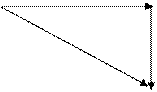
DН3 DН2 DН3 = DН1 + DН2
СО2
Применяя закон Гесса, можно рассчитать тепловые эффекты некоторых реак-ций, которые невозможно осуществить экспериментально. Обычно в расчётах пользуются стандартными величинами теплот Qoобр (или энтальпий DHoобр.) обра-зования.
Стандартная теплота (энтальпия) образования – это тепловой эффект реакции образования 1 моля соединения из простых веществ при стандартных условиях (298 K; 101,3 кПа). Единица измерения – кДж/моль. У большинства соединений они определены и сведены в таблицы. Для большинства природных соединений Qoобр.,298 >0 (или DHoобр.,298 < 0, т.к. Q = – DН). Стандартная теплота (или энтальпия) образования простых веществ принята равной нулю.
Стандартная теплота (энтальпия) сгорания – это тепловой эффект реакции сгорания 1 моля вещества с образованием высших оксидов (СО2, SO2, Н2О) и азота при стандартных условиях: Qoсгор., 298 (DHoсгор,298), кДж/моль. Поскольку горение экзотермический процесс, для большинства природных соединений Qoсгор., 298> 0 (DHoсгор,298<0). Стандартная теплота (энтальпия) сгорания СО2, SO2, Н2О равна нулю. При биологическом окислении азот остается в составе мочевины СO(NH2)2, а сера в H2S. В связи с этим стандартная энтальпия сгорания в условиях биологического окисления отличается от обычных условий.
Так как энтальпия (Н) является функцией состояния системы, то тепловые эффекты реакций можно рассчитать по закону Гесса. Для определения теплоты реакции образования соединений из суммы энтальпий (теплот) образования продуктов вычитают сумму энтальпий (теплот) образования исходных веществ. Например, при стандартных условиях для реакции aA + bB = dD + cC тепловой эффект образования рассчитывается по уравнению:
DHо = [dDHообр.,D + cDHообр.,С] – [aDHообр.,A– bDHо обр.,В].
В случае расчёта теплового эффекта реакции сгорания сумму теплот сгорания продуктов вычитают из суммы сгорания реагентов:
DHо = [аDHосгор.,А + bDHосгор.,В] – [dDHосгор.,D – сDHо сгор.,С].
По знаку теплового эффекта реакции делятся на экзотермические (DHo < 0) и эндотермические (DHo > 0). Например, окисление глюкозы (С6Н12О6(тв) + 6О2(г)  6СО2(г) + 6Н2О(ж), DH1 = – 2808 кДж) происходит с выделением теплоты, т.е. этот процесс – экзотермический. Один из этапов образования белка в организме – образование лей-цинглицина (ЛейГли) из аминокислот лейцина (Лей) и глицина (Гли) сопровождается поглощением теплоты: Лей + Гли = ЛейГли + Н2О, DH = 25 кДж. Этот процесс эндотермический.
6СО2(г) + 6Н2О(ж), DH1 = – 2808 кДж) происходит с выделением теплоты, т.е. этот процесс – экзотермический. Один из этапов образования белка в организме – образование лей-цинглицина (ЛейГли) из аминокислот лейцина (Лей) и глицина (Гли) сопровождается поглощением теплоты: Лей + Гли = ЛейГли + Н2О, DH = 25 кДж. Этот процесс эндотермический.
Дата добавления: 2015-10-05; просмотров: 1769;
