Способы выражения концентрации растворов
Концентрация является важной характеристикой раствора: она определяет относительное содержание компонентов в растворе.
Используются различные способы выражения концентрации растворов.
Молярная концентрация- это количество вещества, содержащееся в одном литре раствора (моль/л):
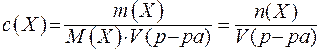
 ,
,
где:  - количество вещества Х (моль);
- количество вещества Х (моль);
V(р-ра) - объём раствора (л).
Молярная концентрация эквивалента (нормальная концентрация) - это число молей эквивалентов вещества, содержащихся в одном литре раствора (моль/л):
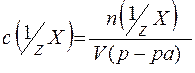 ,
,
где: 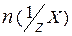 - количество вещества эквивалентов (моль);
- количество вещества эквивалентов (моль);
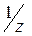 - фактор эквивалентности;
- фактор эквивалентности;
V(р-ра) - объём раствора (л).
Моляльная концентрация- это количество вещества, содержащееся в одном килограмме растворителя (моль/кг):
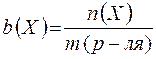 ,
,
где: 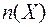 - количество вещества Х (моль);
- количество вещества Х (моль);
m (р-ля) - масса растворителя (кг).
Массовая доля равна отношению массы растворённого вещества к массе раствора (безразмерная величина):
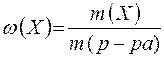 ,
,
где: т (Х) - масса растворенного вещества (г);
т (р-ра) - масса раствора (г).
Молярная доляравна отношению количества растворённого вещества к общему количеству веществ в растворе (безразмерная величина):
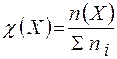 ,
,
где: п (Х) - количество растворенного вещества (моль);
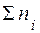 - общее количество вещества всех компонентов раствора.
- общее количество вещества всех компонентов раствора.
1.6.1. Ионно-молекулярные (ионные) реакции обмена
Все многообразие химических превращений можно подразделить на реакции, протекающие без изменения степени окисления атомов элементов, входящих в состав реагентов и продуктов, и реакции, сопровождающиеся изменением степени окисления атомов элементов, входящих в состав реагентов и продуктов – окислительно-восстановительные реакции.
Реакции без изменения степени окисления атомов элементов наиболее часто протекают с участием ионов в растворах, поскольку исходными реагентами таких реакций являются электролиты.
Обменные ионно-молекулярные реакции с участием электролитов представляют собой процессы замещения одного иона другим одноименным ионом (катионом или анионом) в молекуле электролита. В этих реакциях ионы обладают существенно более высокой реакционной способностью по сравнению с молекулами, и поэтому скорость прямой и обратной реакций зависит от концентрации ионов, фигурирующих в левой и правой частях уравнения. Из сказанного следует, что основным фактором, влияющим на смещение равновесия в реакциях растворов электролитов, является изменение концентрации ионов, и обменные реакции преимущественно протекают в направлении образования из ионов молекулярных соединений: осадков, газов или слабых электролитов, что полностью соответствует принципу Ле-Шателье. Если ионы, фигурирующие в правой части уравнений реакций, объединяются между собой в молекулярные формы, их концентрация резко падает, что обеспечивает смещение равновесия в сторону образования таких ионов.
Ионно-молекулярные или ионные уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты полностью диссоциированы и поэтому записываются в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записываются в молекулярной форме.
Растворимость электролитов в насыщенном растворе определяется произведением растворимости ПР, представляющим собой произведение концентраций ионов (катиона и аниона), находящихся в равновесии с осадком вещества, образуемого этими ионами в степенях, равных стехиометрическим коэффициентам при этих ионах. Так, для осадка 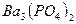 , находящегося в равновесии с ионами
, находящегося в равновесии с ионами 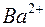 и
и 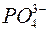 в растворе
в растворе
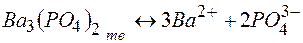
произведение растворимости выражается равенством:
ПР 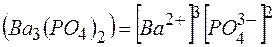 .
.
Зная значение ПР, можно решать вопросы, связанные с образованием или растворением осадков в химических реакциях.
Важным количественным показателем, используемым при анализе ионных реакций, является водородный показатель рН, характеризующий концентрацию ионов водорода в водных растворах
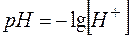 (1)
(1)
При этом концентрация ионов водорода связана с ионным произведением воды Кw , вытекающим из ее обратимой диссоциации
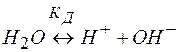 (2)
(2)
Константа диссоциации в соответствии с уравнением (2) определяется как
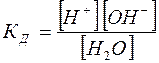 (3)
(3)
Поскольку концентрации [H+] и [OH–]пренебрежимо малы по сравнению с концентрацией воды, последнюю можно считать постоянной. Тогда уравнение (3) можно записать в виде
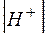
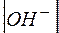 =
= 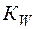 (4)
(4)
где 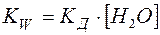
Как всякая константа, КW не зависит от концентрации Н+ и ОН–в растворе. Так, если в воду добавить протонную кислоту, то концентрация ионов Н+ резко возрастет. Тогда равновесие (2) заметно сместится в левую сторону, что приведет к значительному снижению концентрации ионов ОН–, но ионное произведение воды останется неизменным. Таким образом, в водных растворах концентрации Н+ и ОН–в условиях постоянства температуры взаимно связаны между собой: зная концентрацию одного из них, можно определить концентрацию другого, пользуясь выражением (4).
При обычной температуре 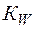 =10–14. Поэтому в нейтральном растворе
=10–14. Поэтому в нейтральном растворе 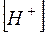 =
= 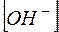 =
= 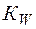 0,5=10–7 моль/л и рН в соответствии с выражением (1) равен 7.
0,5=10–7 моль/л и рН в соответствии с выражением (1) равен 7.
Дата добавления: 2015-10-05; просмотров: 924;
