В кислой среде и .
В щелочной среде 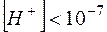 и
и 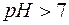 .
.
По аналогии с рН введен показатель рОН:
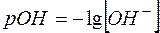 (5)
(5)
и показатель 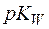 , равный
, равный 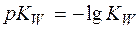 . Тогда, логарифмируя уравнение (4), имеем:
. Тогда, логарифмируя уравнение (4), имеем:
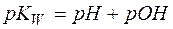 (6)
(6)
Так как 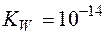 , то
, то 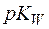 =14, и равенство (6) приводится к виду:
=14, и равенство (6) приводится к виду:
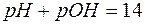 . (7)
. (7)
Уравнения (6) и (7) показывают, что зная рН, можно рассчитать рОН, и наоборот, по известному значению рОН легко определяется рН.
Частным случаем ионных реакций является гидролиз солей – обменное взаимодействие соли с водой, приводящее к образованию слабого электролита. Показателем глубины протекания этой реакции является степень гидролиза, определяемая как отношение концентрации гидролизованных молекул “с” к исходной концентрации растворенных молекул “сO”:
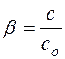 (8)
(8)
Гидролиз является реакцией, обратной нейтрализации, поэтому его результатом является образование пары кислота – основание.
Если объектом гидролиза являются соли сильного основания и сильной кислоты, то такие соли не гидролизуются, так как обратная гидролизу реакция необратима.
Дата добавления: 2015-10-05; просмотров: 1040;
