Изомеризационные превращения спиртов
Изомеризационные превращения спиртов более разнообразны по сравнению с превращениями углеводородов, поскольку наличие в молекулах гидроксильной группы создает дополнительные возможности перегруппировок. Изомеризация осуществляется в присутствии катализаторов в гомогенных или гетерогенных условиях. Наиболее активными катализаторами являются кислоты, воздействующие как на функциональную группу спиртов, так и на реакционные центры углеродного скелета – двойные связи и напряженные циклы.
3.1.2.1 Ациклические спирты. Особенно склонны к изомеризации спирты аллильной структуры – линалоол, гераниол, нерол, среди которых наиболее активен третичный спирт линалоол.
Под действием кислот при повышенной температуре линалоол образует сложную смесь, в которой наряду с линалоолом находятся гераниол, терпинеол, примеси нерола и других спиртов, а также углеводороды. То же самое наблюдается при ацетилировании линалоола. Исследованиями Тимана, Земмлера, Барбье еще в 1891-1892 гг. показано, что при действии на линалоол уксусного ангидрида наряду с линалилацетатом образуются ацетаты гераниола, терпинеола, нерола и другие соединения.
Современные представления о механизмах органических реакций позволяют объяснить наблюдаемые превращения.
Протонирование гидроксильной группы способствует отщеплению воды от молекулы линалоола:

1 2
Процесс протекает легко, поскольку приводит к образованию сопряженных (мезомерных) карбениевых ионов 1 и 2, относящихся к наиболее устойчивым и легко возникающим интермедиатам. Образование двух стереоизомерных катионов объясняется свободным вращением концевой винильной группы в молекуле линалоола относительно простой связи, и невозможностью такого вращения в катионах 1 и 2 в связи с возникновением за счет сопряжения дополнительной частичной π-связи между атомами 2 и 3. Отсутствие вращения фиксирует конформации 1 и 2 в качестве геометрических изомеров.
Обратное присоединение воды к катионам 1 и 2, происходящее в сопряженных системах по крайним атомам углерода, приводит к образованию, наряду с линалоолом, его аллильных изомеров – нерола и гераниола:
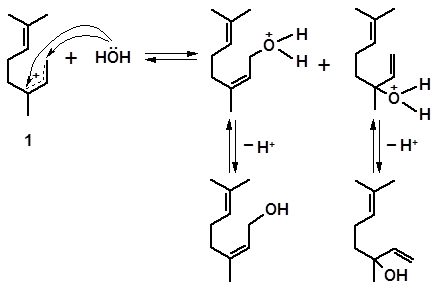
нерол линалоол
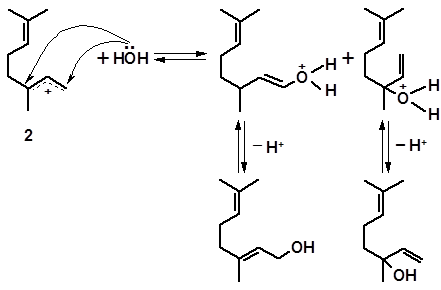
гераниол линалоол
Рассмотренное превращение линалоола является примером аллильных перегруппировок, заключающихся в обмене местами функциональной группы и находящейся к ней в аллильном положении двойной связи. Аллильные перегруппировки обратимы, поэтому гераниол и нерол способны, в свою очередь, изомеризоваться в линалоол.
Катион 1 в конформации, изображенной в приведенных схемах механизма, предполагает возможность сближения двойной связи с крайним атомом мезомерного катиона на расстояние, соответствующее длине химической связи. На таком расстоянии напряженность электрического поля положительного заряда весьма велика и вызывает разрушение легко поляризуемой π-связи и возникновение новой σ-связи, замыкающей шестизвенный цикл с образованием углеродного скелета п-ментана (п-ментановая циклизация):
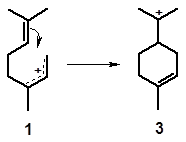
Циклизация протекает легко и необратимо и является причиной того, что в продуктах изомеризации линалоола нерол почти полностью отсутствует.
Присоединение воды к катиону 3 приводит к образованию α-терпинеола:
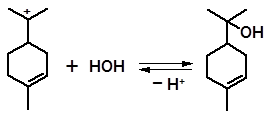
3 α-терпинеол
Следует отметить, что образование α-терпинеола из линалоола протекает стереоспецифично, т.е. из энантиомера линалоола образуется отдельный энантиомер α-терпинеола. Это свидетельствует о том, что циклизация катиона 1 протекает непосредственно в момент его образования, когда на пространственную структуру переходного состояния оказывает влияние отщепляющаяся молекула воды.
Наряду с изомеризационными превращениями, в условиях процесса наблюдается дегидратация спиртов. Катионы 1, 2, 3, отщепляя протон, превращаются в углеводороды:
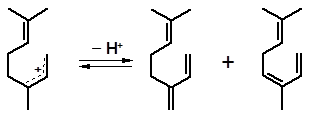
1мирцен оцимен
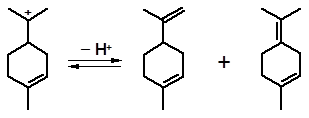
3 лимонен терпинолен
Состав углеводородов, учитывая возможность их собственных перегруппировок, оказывается сложным и зависит от конкретных условий процесса. Масштабы дегидратации возрастают с повышением температуры, так как отщепление воды – эндотермический процесс.
Аналогичные процессы протекают и при ацетилировании линалоола уксусным ангидридом. Образующийся первоначально линалилацетат под действием кислоты отщепляет молекулу уксусной кислоты с образованием тех же интермедиатов, которые возникают при отщеплении воды от линалоола:
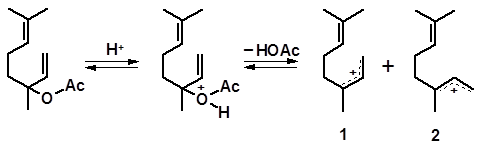
Далее процесс протекает так же, как изомеризация линалоола, за исключением того, что вместо изомерных спиртов образуются их ацетаты.
Аллильная перегруппировка линалоола имеет практическое значение, поскольку позволяет получить из относительно доступного линалоола гераниол и нерол, обладающие запахом розы. Процесс предложено проводить, используя в качестве катализаторов соли переходных металлов (V, Mo, W, Cr и др.), которые вызывают меньше побочных превращений по сравнению с кислотами. Например, в присутствии 0,1 % (NH4)2МоО4 линалоол образует равновесную смесь, в которой содержится около 60 % линалоола, 20 % гераниола и 12 % нерола. При использовании вместо линалоола его борных эфиров выход нерола и гераниола может быть повышен до 60-70 %.
Известны изомеризационные превращения спиртов, протекающие за счет двойных связей молекулы без участия группы –ОН. Лавандулол в кислой среде способен к циклизации, в которой задействованы обе двойные связи:
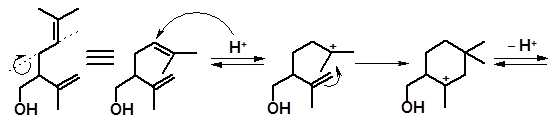
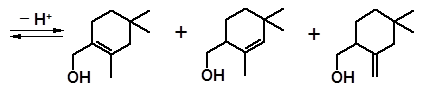
изомеры лавандулола
Аналогичный процесс может протекать у гераниола и нерола. Показано (Мюллер, 1921), что в присутствии фосфорной кислоты ацетат гераниола может циклизоваться с образованием производных ряда сафранана:
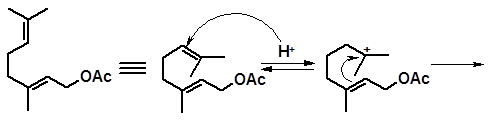
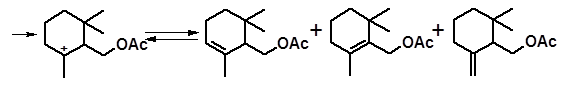
α-изомер β-изомер γ-изомер
Омылением образовавшихся ацетатов получают смесь изомеров циклогераниола, запах которых высоко ценится парфюмерами.
Цитронеллол устойчив к изомеризационным превращениям, поскольку молекула имеет только одну двойную связь, а образование катиона за счет гидроксильной группы (с этого начинается превращение) мало вероятно из-за неустойчивости первичных карбениевых ионов.
3.1.2.2 Моноциклические спирты. Изомеризация моноциклических спиртов может приводить к перемещениям двойных связей, гидроксильных групп и к изменению пространственной структуры молекул.
Перемещение двойных связей происходит под действием кислот так- же, как и в молекулах углеводородов. Аналогично протекает перемещение группы –ОН. В качестве примера рассмотрим изомеризацию α-терпи- неола:
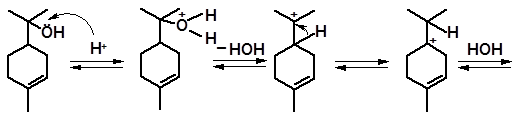
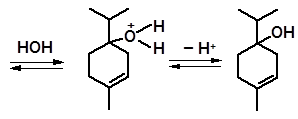
терпинен-4-ол
Терпинен-4-ол присутствует в качестве примеси к α-терпинеолу при получении последнего гидратацией углеводородов в кислой среде.
Практически важным примером изомеризации, приводящей к изменению пространственной структуры молекулы, является превращение нео- и изоментола в ментол. При получении ментола гидрированием тимола образуется смесь диастереомеров:
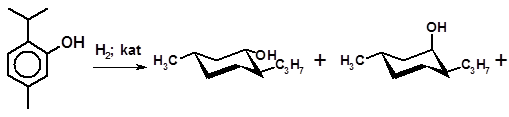 |
(  )-ментол (
)-ментол (  )-неоментол
)-неоментол
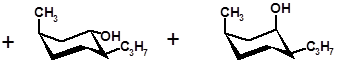
(  )-изоментол (
)-изоментол (  )-неоизоментол
)-неоизоментол
В этой смеси преобладает ментол (около 60 %) как наиболее термодинамически стабильное соединение; неоизоментол присутствует в следовых количествах. После разделения смеси ректификацией нео- и изоментол подвергают изомеризации в тех же условиях, в которых протекает гидрирование тимола, и вновь получают смесь, содержащую около 60 % ментола. Ментол отделяют, а его изомеры снова подвергают изомеризации, добиваясь в итоге их полного превращения в ментол.
Дата добавления: 2015-09-29; просмотров: 2106;
