Химические свойства. Сложные эфиры – типичные электрофилы
Сложные эфиры – типичные электрофилы. Из-за +М-эффекта атома кислорода, связанного с углеводородным радикалом, они проявляют менее выраженный электрофильный характер по сравнению с галогенангидридами и ангидридами кислот:
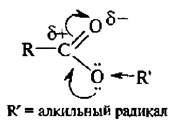
Электрофильность эфиров увеличивается, если углеводородный радикал образует с атомом кислорода сопряженную систему, т. н. активированные эфиры:
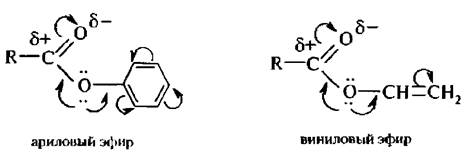
Сложные эфиры вступают в реакции нуклеофильного замещения.
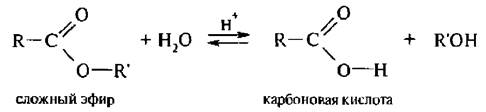
1. Гидролиз сложных эфиров проходит как в кислой, так и в щелочной среде.
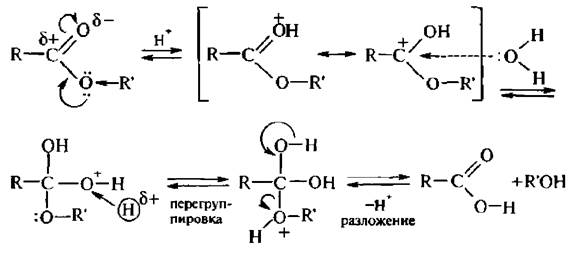
Кислотный гидролиз сложных эфиров – последовательность обратимых превращений, противоположных реакции этерификации:
Механизм этой реакции включает протонирование атома кислорода карбонильной группы с образованием карбкатиона, который реагирует с молекулой воды:
Щелочной гидролиз. Гидролиз в присутствии водных растворов щелочей проходит легче, чем кислотный потому, что гидроксид-анион более активный и менее объемный нуклеофил, чем вода. В отличие от кислотного, щелочной гидролиз необратим:
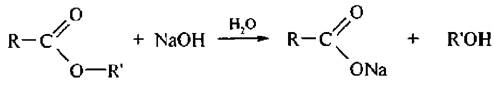
Щелочь выступает не в роли катализатора, а в роли реагента. Гидролиз начинается с нуклеофильной атаки гидроксид-ионом атома углерода карбонильной группы. Образуется промежуточный анион, который отщепляет алкоксид-ион и превращается в молекулу карбоновой кислоты. Алкоксид-ион, как более сильное основание, отрывает протон от молекулы кислоты и превращается в молекулу спирта:
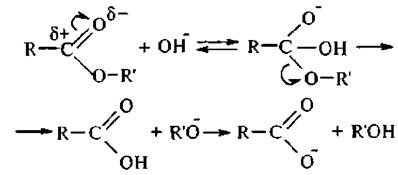
Щелочной гидролиз необратим потому, что карбоксилат-анион имеет высокую делокализацию отрицательного заряда и не восприимчив к атаке спиртового гидроксила.
Часто щелочной гидролиз сложных эфиров называют омылением. Термин произошел от названия продуктов щелочного гидролиза жиров – мыла.
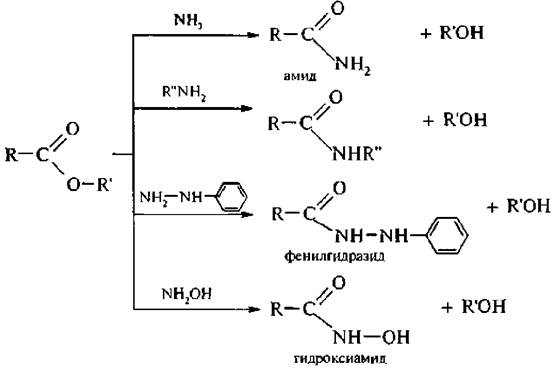
2. Взаимодействие с аммиаком (иммонолиз) и его производными протекает по механизму, аналогичному щелочному гидролизу:
3. Реакция переэтерификации (алкоголиз сложных эфиров) катализируется как минеральными кислотами, так и шеломами:
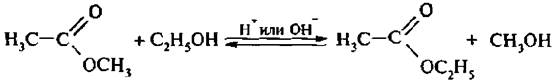
Для смешения равновесия вправо отгоняют более летучий спирт.
4. Сложноэфирная конденсация Кляйзена характерна для эфиров карбоновых кислот, содержащих атомы водорода в α-положении. Реакция протекает в присутствии сильных оснований:
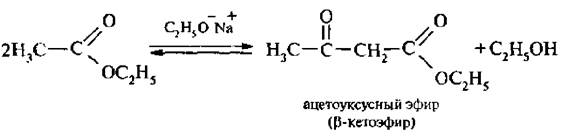
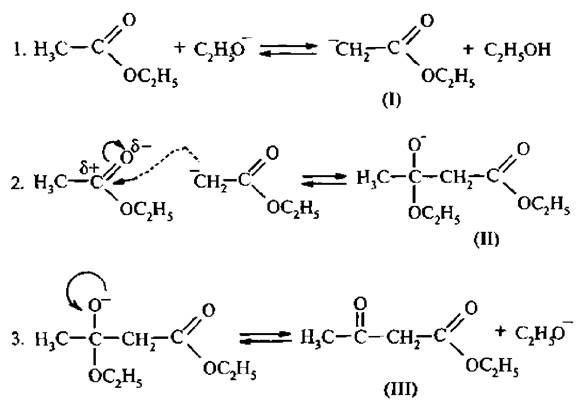
Алкоксид-ион отщепляет протон от α-углеродного атома молекулы эфира. Образуется мезомерно стабилизированный карбанион (I), который, выступая в роли нуклеофила, атакует атом углерода карбонильной группы второй молекулы эфира. Образуется продукт присоединения (II). Он отщепляет алкоксид-ион и превращается в конечный продукт (III). Таким образом, всю схему механизма реакции можно разделить на три стадии:
Если в реакцию вступают два сложных эфира, содержащие α-атомы водорода, то образуется смесь четырех возможных продуктов. Реакция используется для промышленного получения ацетоуксусного эфира.
5. Восстановление сложных эфиров:
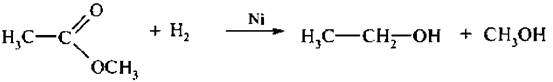
Первичные спирты образуются при действии газообразного водорода в присутствии скелетного никелевого катализатора (никель Ренея).
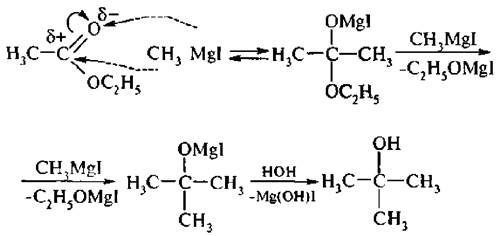
6. Действие магнийорганических соединений с последующим гидролизом приводит к образованию третичных спиртов:
Сложные эфиры имеют большое значение как ацилирующие реагенты, растворители, используются для синтеза альдегидов, кетонов, полимеров («органическоестекло» – плексиглас), лекарственных веществ: этилформиат – для производства витамина В1. Бензилбензоат используют для лечения чесотки. Эти вещества известны как отдушки в парфюмерии (этилформиат, этилацетат) и компоненты пищевых эссенций: грушевой – изоамил ацетат, яблочной – изоамилвалерат, ромовой – этилформиат, ананасовой – этилбутират,
Дата добавления: 2015-09-29; просмотров: 8131;
