Определение жесткости воды
Жесткость воды – совокупность свойств, обусловленных содержанием в ней катионов кальция и магния.
Общая жесткость воды измеряется числом миллимоль-эквивалентов катионов кальция и магния в 1 литре воды, то есть 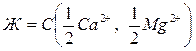 , ммоль/дм3. Жесткость воды можно определить методом комплексонометрического титрования.
, ммоль/дм3. Жесткость воды можно определить методом комплексонометрического титрования.
Комплексонометрический метод титрования основан на использовании реакций образования комплексных соединений катионов с органическими реактивами, называемыми комплексонами.
Комплексоны – это производные аминополикарбоновых кислот. Наибольшее практическое применение имеет комплексон III – динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА или трилон Б):
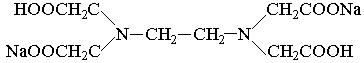
Трилон Б образует растворимые в воде внутрикомплексные соли (хелаты) со многими катионами металлов, например с Мg2+:
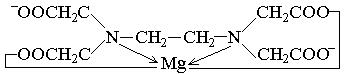
Комплексный анион этих солей практически не диссоциирует, его можно обозначить Y4–. Катионы, независимо от заряда, взаимодействуют с трилоном Б в эквимолярных количествах (в соотношении 1 : 1). Например:
Н2Y2– + Са2+ = СаY2– + 2Н+,
Н2Y2– + Bi3+ = BiY– + 2Н+,
Н2Y2– + Zr4+ = ZrY + 2Н+
Поскольку в результате реакции выделяются ионы водорода, в кислой среде равновесие смещается влево, в сторону разрушения комплекса, поэтому при определении общей жесткости воды реакцию следует проводить в щелочной среде (для сдвига равновесия вправо) при рН = 10. Однако при добавлении щелочи в осадок может выпадать Mg(OH)2, поэтому используют аммиачно-аммонийную буферную смесь (равные объемы 0,1 М NH4Cl и 0,1 M NH4OH, рН » 9).
Точку эквивалентности устанавливают с помощью металлоиндикатора – эриохрома черного или хрома темно-синего, меняющих окраску раствора в точке эквивалентности от винно-красной до сине-фиолетовой в результате реакций:
Ca2+ (Mg2+) + HInd2– + OH– = CaInd– (MgInd–) + H2O
бесцветный сине-голубой винно-красный
CaInd– (MgInd–) + Н2Y2– + OH– = СаY2– (MgY2–) + HInd2– + H2O
винно-красный бесцветный бесцветный сине-голубой
Ход определения общей жесткости воды состоит в следующем.
Промываем бюретку рабочим раствором трилона Б и заполняем ее до нулевого деления.
Промываем пипетку объемом 50 см3 анализируемым раствором (водой). Аликвотную часть исследуемого раствора, отмеренную пипеткой, помещаем в коническую колбу для титрования, добавляем 5 см3 аммиачно-аммонийного буфера и 1–2 капли раствора индикатора хрома темно-синего.
Полученную смесь титруем при непрерывном перемешивании рабочим раствором трилона Б до перехода винно-красной окраски в сине-голубую (через фиолетовую). Под конец титрование проводят очень медленно, тщательно перемешивая смесь после добавления каждой капли титранта.
Титрование повторяем для получения не менее 3-х результатов, отличающихся не более, чем на 0,1 см3. Затем определяем средний объем раствора ЭДТА, идущий на титрование 50 см3 воды. Результаты записываем в таблицу.
Расчет жесткости воды проводим по формуле:
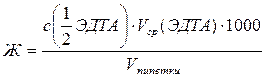 , ммоль/дм3 , ммоль/дм3
| (11) |
где Vср(ЭДТА) и с( 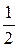 ЭДТА) – средний объем трилона Б и его моль-эквивалентная концентрация.
ЭДТА) – средний объем трилона Б и его моль-эквивалентная концентрация.
Опыт повторяем с другим образцом воды.
Сравниваем жесткость речной и дождевой (водопроводной и кипяченой…) воды.
Результаты эксперимента
Объемы раствора трилона Б, расходуемые на титрование 50 см3 ____________воды
| Результаты титрования, V см3 | Средний объем Vср, см3 | ||
По результатам титрования рассчитываем жесткость:
Дата добавления: 2015-09-29; просмотров: 2685;
