Пипетки
Пипеткиприменяются для точного отмеривания определенного объема раствора и перенесения его из одного сосуда в другой. Они бывают двух типов: градуированные (измерительные) и мерные, последние, как правило, и применяются в титриметрии (рис. 2).
Мерные пипетки представляют собой узкие трубки с расширением в середине. В верхней узкой части находится круговая метка. Пипетки бывают разной вместимости, обычно 10; 15; 20; 25; 50 мл. Пипетки калиброваны на выливание: если заполнить пипетку до метки и вылить жидкость, ее объем будет соответствовать вместимости, указанной на пипетке, но при этом нужно строго соблюдать нижеследующие правила обращения с пипеткой.
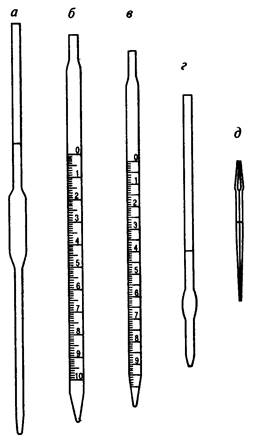
Рисунок 2 – Обычные пипетки:
а – мерная (Мора); б – градуированная; в – серологическая; г – Оствальда-Фолина; д – «ламбда»
Пипетку тщательно моют моющими смесями, заполняя ими пипетку с помощью специального приспособления (пипетатора или шприца), затем ее многократно ополаскивают сначала водопроводной, а затем дистиллированной водой. Убедившись в том, что вода смачивает внутренние стенки ровным слоем, не оставляя капель (в противном случае мытье пипетки повторяют), всю внутреннюю поверхность пипетки ополаскивают 2-3 раза тем раствором, который предполагается отбирать пипеткой.
Для этого раствор наливают в сухой чистый стакан и используют его исключительно для промывания пипетки. Нельзя погружать непромытую пипетку в колбу с исследуемым или стандартным раствором. Ополаскивая пипетку раствором, заполняют ее каждый раз примерно на 1/3 объема, горизонтально вращая, смачивают раствором всю внутреннюю поверхность пипетки.
Затем берут пипетку большим и средним пальцами правой руки, вытирают ее внешнюю часть кусочком фильтровальной бумаги и, погружая ее нижний конец глубоко в раствор, наполняют ее раствором так, чтобы уровень жидкости в ней оказался выше метки примерно на 2 см. После этого быстро зажимают верхнее отверстие пипетки указательным пальцем и, подняв пипетку, удаляют капли раствора с внешней стороны пипетки кусочком фильтровальной бумаги. Затем слегка приоткрывают отверстие, чтобы стекла лишняя жидкость и нижний край мениска коснулся метки (при этом метка должна находиться на уровне глаз). Вновь плотно закрывают отверстие и переносят пипетку в заранее подготовленный сосуд (чаще всего в колбу для титрования). Держа пипетку вертикально, отнимают от ее отверстия палец и дают жидкости свободно вытекать; когда вся жидкость вытечет, прикасаются кончиком пипетки к стенке сосуда и ждут 20 с, пока вытекут остатки (рис. 3).
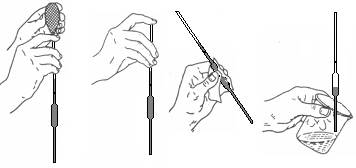
а б в г
Рисунок 3 – Приемы работы с мерной пипеткой:
а – втяните жидкость выше метки; б – удерживайте уровень жидкости выше метки указательным пальнем; в – слегка наклоните пипетку и вытрите капли снаружи; г – дайте жидкости вытечь из
Порядок работы
1. Приготовление раствора. Разбавленный раствор соляной кислоты готовим из концентрированного раствора с известной плотностью (rр-ра).
По таблице в справочнике определяем процентную концентрацию исходного раствора кислоты и вычисляем объем этого раствора, необходимый для приготовления 100 мл раствора с заданной моль-эквивалентной концентрацией ( 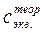 ).
).
Расчеты проводим по следующим формулам:
1) рассчитываем массу HCl, содержащуюся в 100 см3 раствора с концентрацией 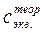 :
: 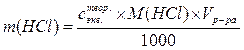 = …
= …
2) рассчитываем массу исходного раствора с процентной концентрацией w(HCl), содержащую рассчитанную массу HCl:
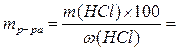 …
…
3) рассчитываем объем исходного раствора HCl :
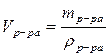 = …
= …
Вычисленный объем раствора исходной соляной кислоты из бюретки переливаем в мерную колбу вместимостью 100 мл, затем в колбу наливаем дистиллированную воду до половины объема, тщательно взбалтываем, после чего прибавляем воду до метки (нижний край мениска должен касаться метки на горле колбы). Закрываем колбу пробкой и вновь тщательно перемешиваем раствор, перевертывая колбу.
2. Проверка концентрации приготовленного раствора. Бюретку заполняем стандартным раствором NaOH с моль-эквивалентной концентрацией 0,1000 моль/дм3.
Пипетку Мора ополаскиваем приготовленным раствором соляной кислоты (с помощью груши набираем раствор HCl выше метки и выливаем его в сливной стакан). Затем отмеряем пипеткой 10 мл приготовленного раствора HCl (нижний край мениска должен касаться метки) и содержимое пипетки переносим в коническую колбу для титрования. Добавляем 1-2 капли фенолфталеина.
К полученному раствору из бюретки постепенно добавляем стандартный раствор щелочи, при этом непрерывно взбалтываем содержимое колбы. Добавляем раствор NaOH до появления бледно-розовой окраски. Этот момент соответствует полной нейтрализации кислоты щелочью. Описанный прием в аналитической химии называется титрованием.
Титрование повторяем несколько раз до получения трех результатов, отличающихся не более, чем на 0,1 мл. Результаты титрования записываем в таблицу.
Таблица 1 – Объемы раствора щелочи NaOH, необходимые для титрования 10 см3 раствора кислоты HCl
| Объем раствора кислоты, см3 | Средний объем NaOH, см3 | ||
Рассчитываем моль-эквивалентную концентрацию приготовленного раствора соляной кислоты.
Расчет концентрации HCl производим по среднему значению израсходованного объема щелочи, используя формулу:
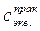 (HCl) ´V(HCl) = сэкв(NaOH) ´Vср(NaOH),
(HCl) ´V(HCl) = сэкв(NaOH) ´Vср(NaOH),
где 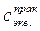 (HCl) – моль-эквивалентная концентрация соляной кислоты (моль/дм3), которую определяют опытным путем;
(HCl) – моль-эквивалентная концентрация соляной кислоты (моль/дм3), которую определяют опытным путем;
V(HCl) – объем кислоты (в данном случае 10 мл);
сэкв(NaOH) – моль-эквивалентная концентрация стандартного раствора щелочи (титранта, в моль/дм3), равная 0,1000 моль/дм3;
Vср (NaOH) – средний объем раствора щелочи (в мл), пошедший на титрование.
Рассчитываем относительную ошибку, допущенную при приготовлении раствора заданной концентрации
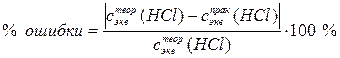 , ,
|
где 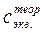 (HCl) – моль-эквивалентная концентрация кислоты, заданная преподавателем;
(HCl) – моль-эквивалентная концентрация кислоты, заданная преподавателем;
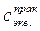 (HCl) – моль-эквивалентная концентрация кислоты, приготовленная вами и найденная титрованием.
(HCl) – моль-эквивалентная концентрация кислоты, приготовленная вами и найденная титрованием.
Делаем вывод.
Дата добавления: 2015-09-29; просмотров: 5204;
