Опыт 5. Химическое равновесие
В пробирку налить 10 мл воды и добавить по 1-2 капли насыщенных растворов FeCI3 и NH4SCN. Окрашенный в красный цвет раствор разделить поровну на 4 пробирки.
Написать уравнение обратимой реакции и выражение константы равно-весия.
Затем в первую пробирку добавить 2-3 капли насыщенного раствора FeCI3. Во вторую пробирку прилить 2-3 капли насыщенного раствора NH4SCN. Что наблюдаете? Почему изменение концентрации NH4SCN вызывает более эффективное смещение равновесия, чем изменение концентрации FeCI3?
В третью пробирку добавить немного твердого NH4CI, сильно взболтать. Сравнить цвет растворов в пробирках 3 и 4, дать объяснения.
Опыт 6.В растворах, содержащих шестивалентный хром, существует равновесие:
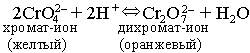
или Cr2O72– + 2ОН– Û 2 CrO42– + H2O.
В пробирку налейте 3-4 мл раствора хромата калия K2CrO4 и прибавьте несколько капель раствора серной кислоты до изменения окраски. Когда раствор станет оранжевым, добавьте по каплям раствор щелочи KОН до появления желтой окраски. После этого можно опыт повторить: снова прибавить раствор кислоты и получить оранжевую окраску, прибавить раствор щелочи и получить желтую окраску.
Дата добавления: 2015-09-29; просмотров: 1162;
