МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
Метод МО является более совершенным методом описания строения молекул. Если метод ВС позволяет судить о направленности строения молекул, определяет форму молекулы или иона, то метод МО дает более полную информацию о строении, указывает на прочность связи, возможность существования молекулы, магнитные свойства вещества.
В основе этого метода лежит представление о том, что все электроны данной молекулы или иона (как и в атоме) распределяются по соответствующим молекулярным орбиталям. По аналогии с атомными s-, p-, d-, f- орбиталями, молекулярные орбитали обозначаются греческими буквами s-, p-, d-, j-, ….
Описать молекулу по теории МО – это значит определить ее орбитали, их энергию и выяснить характер распределения электронов по орбиталям в порядке возрастания их энергии. Образование молекулярных орбиталей можно представить как результат сложения и вычитания взаимодействующих атомных орбиталей. Метод МО основан на следующих правилах:
1. При сближении атомов до расстояния химических связей, из атомных орбиталей (АО) образуются молекулярные, число полученных молекулярных орбиталей равно числу исходных атомных.
2. Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания двух атомных орбиталей образуются две молекулярные. Одна из них имеет меньшую энергию по сравнению с исходными атомными и называется связывающей, а вторая молекулярная орбиталь обладает большей энергией, чем исходные атомные орбитали, и называется разрыхляющей.
3. При перекрывании атомных орбиталей возможно образование и s -связи (перекрывание по оси химической связи), и p- связи (перекрывание по обе стороны от оси химической связи).
5. На одной молекулярной орбитали (как, впрочем, и атомной) возможно нахождение не более двух электронов (принцип Паули).
6. Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии).
7. Заполнение орбиталей вырожденных (с одинаковой энергией) происходит последовательно по одному электрону на каждую из них.
  |
Схема образования и форма данных молекулярных орбиталей с учётом изложенного выше представлена на рис.3.7:
В силу осевой симметрии обеих молекулярных орбиталей относительно линии, связывающей ядра атомов, это σ-орбитали. В общем случае обозначение МО, кроме типа связи (σ-, π-, δ-) содержит также указание на их характер (связывающие, разрыхляющие, несвязывающие) и вид исходных АО: например, 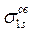 и
и 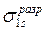 или σs и
или σs и 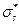 (звёздочка указывает на возбуждённое состояние).
(звёздочка указывает на возбуждённое состояние).
  |
Результаты линейной комбинации исходных АО в методе МО нагляднее демонстрировать в виде энергетической диаграммы. Для рассмотренного выше случая энергетическая диаграмма представлена на рис.3.6.
Заполнение молекулярных орбиталей электронами подчиняется тем же основным принципам, что и атомных орбиталей. В соответствии с этим энергетическая диаграмма молекулы водорода будет выглядеть так, как представлено на рис.3.7.:
 |
В нормальном состоянии молекулы водорода оба её электрона согласно принципу минимума энергии занимают наиболее низкую орбиталь
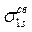 и согласно принципу Паули имеют противоположные спины. Таким образом, ёмкость МО так же, как и АО составляет два электрона. Суммарный спин при этом равен нулю, т.е. молекула должна быть диамагнитной, что и наблюдается в действительности.
и согласно принципу Паули имеют противоположные спины. Таким образом, ёмкость МО так же, как и АО составляет два электрона. Суммарный спин при этом равен нулю, т.е. молекула должна быть диамагнитной, что и наблюдается в действительности.
Изучение молекулярных спектров двуядерных молекул образованных элементами начала 2-ого периода вплоть до азота N2 дало следующий порядок следования МО:
σ1s < σ1s* < σ2s < σ2s* < πy = πz < σx < πy* = πz* < σx* (11)
 |
Другим характерным примером, который обычно используют для того, чтобы продемонстрировать дополнительные возможности метода МО, недоступные МВС, является описание строения молекулярного кислорода О2. Так, например, при совпадении данных обоих методов о двукратности связи в молекуле кислорода метод ВС не позволяет предсказывать магнитные свойства, согласно ему данная молекула диамагнитна, т.к. все электроны спарены:
В действительности молекулярный кислород парамагнитен. Метод МО позволяет объяснить это, как видно из рис. 14, наличием двух неспаренных электронов на π-разрыхляющих орбиталях (πy* и πz*).
 |
Порядок связи (кратность связи) оценивается полуразностью числа связывающих и разрыхляющих электронов:
е - (связ.) – е - (разр.)
Порядок связи = ——————— ;
где:
е - (связ.) - число связывающих электронов;
е - (разр.) – число разрыхляющих электронов.
Характер распределения электронов по молекулярным орбиталям позволяет объяснить магнитные свойства молекул. По магнитным свойствам различают парамагнитные (обладают собственным магнитным полем) и диамагнитные вещества (не обладают собственным магнитным полем). Парамагнитными считаются те молекулы или ионы, у которых имеются непарные электроны на молекулярных орбиталях (МО), у диамагнитных – все электроны парные.
Дата добавления: 2015-09-29; просмотров: 1364;
