Ковалентная связь – связь, образованная парой электронов с противоположно направленными спинами.
Она может образоваться двумя способами: по обменному механизму и донорно-акцепторному (см. далее).
В зависимости от характера распределения электронной плотности молекулы могут быть полярными и неполярными. Если в молекуле каждое электронное облако, образованное общей парой электронов, распределяется в пространстве симметрично относительно ядер обоих атомов, то такая связь называется неполярной (H2, Cl2, O2, N2). Если же соединение состоит из атомов различных элементов и общее электронное облако смещено в сторону одного из атомов, то такая связь считается полярной (NH3, CH4). В полярных молекулах общее электронное облако смещается к более электроотрицательному атому, и в тем большей степени, чем больше различаются электроотрицательности взаимодействующих атомов.
Полярность молекул оказывает заметное влияние на свойства образуемых ими веществ. Взаимное притяжение полярных молекул и упрочнение связи между ними указывает на то, что вещества, образованные такими молекулами, имеют более высокие температуры плавления и кипения. Жидкости, состоящие из полярных молекул, способствуют электростатической диссоциации растворенных в них веществ.
Следует отметить, что изо всех известных типов химической связи наибольшее внимание заслуживает ковалентная связь, которая в зависимости от способа перекрывания атомных орбиталей (АО) может образовывать (сигма), (пи) и (дельта)- связи.

В качестве первого примера рассмотрим образование молекулы водорода Н2 в виде схемы (1):
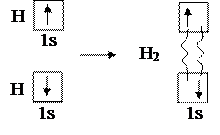

В качестве второго примера рассмотрим описание молекулы аммиака NН3, в состав которой, наряду с тремя атомами водорода, входит атом азота, у которого валентность совпадает с числом неспаренных валентных электронов (схема 2):
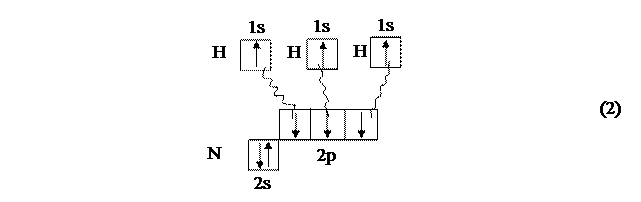
 |
Напомним, что представленный выше способ получил название обменного механизма образования ковалентной связи, когда каждый атом предоставляет на связь по одному неспаренному электрону. Однако в методе ВС нет ограничений, налагаемых на «происхождение» общей электронной пары между атомами. Возможен и иной, донорно-акцепторный механизм образования ковалентной связи, когда один из партнёров предоставляет для её образования не один электрон, а готовую пару электронов (неподелённую электронную пару НЭП), а второй – только свободную орбиталь (3):
В рассмотренном примере атом В является донором электронной пары, а атом А – акцептором.
Примером вещества (атома) с НЭП является представленный на схеме 2 атом азота в молекуле аммиака. Это позволяет ему участвовать в образовании ещё одной ковалентной связи в качестве донора электронной пары.
 |
В качестве атома-акцептора может служить, например, положительный ион водорода Н+, вообще лишённый электронов. Его незаполненная 1s-орбиталь (свободная АО) показывается следующим образом (4):
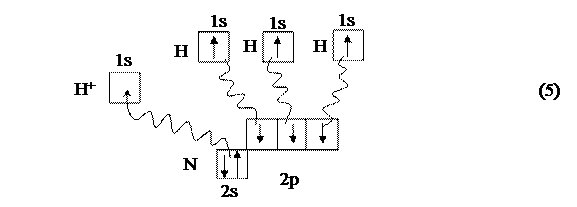 |
Поэтому между молекулой аммиака NH3 и ионом водорода Н+ возможно взаимодействие по донорно-акцепторному механизму; НЭП атома азота становится общей для двух атомов, возникает ковалентная связь, в результате чего образуется катион аммония NH4+ (5):
 | |||
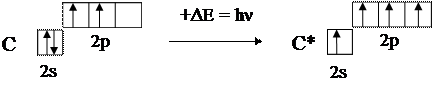 | |||
Рассмотрим классический пример – образование молекулы метана СН4. В нормальном состоянии атом углерода, как показано на схеме (6), содержит только два неспаренных электрона, тогда как их требуется четыре. Процесс перехода атомов в возбуждённое состояние обычно отражают следующей схемой, в которой возбуждённое состояние отмечается звёздочкой у символа химического элемента:
В возбуждённом состоянии атом углерода имеет во внешнем слое необходимые четыре неспаренных электрона, что позволяет показать образование молекулы СН4 следующим образом:
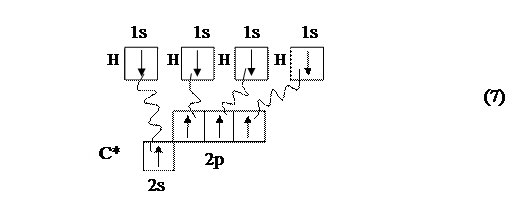 |
Из представленной схемы (7) видно, что валентные возможности атома углерода на этом исчерпаны.
Для описания образования химической связи существует несколько методов. Наиболее часто применяются два: метод валентных связей и метод молекулярных орбиталей.
Дата добавления: 2015-09-29; просмотров: 1693;
