Некоторые представители
| Формула | ИЮПАК номенклатура | Тривиальная номенклатура |
| СH3-ОH | метанол | метиловый спирт |
| C2H5-OH | этанол | этиловый спирт |
| CH3-CH2-CH2OH | 1-пропанол | первичный пропиловый спирт |
| СH3-CH-CH3 ô OH | 2-пропанол | вторичный пропиловый спирт изопропанол |
d- d+
Физические свойства. Вследствие полярности ОН – связи и наличия диполя для спиртов характерно образование так называемых водородных связей (Н-связей). Н-связь – это связь по типу диполь-дипольного притяжения между электроотрицательным элементом одной молекулы (таким, как O, N, F, Cl, S), являющимся отрицательным концом диполя, и атомом водорода другой молекулы, являющимся положительным концом диполя. Эта связь слабая – 4–5 ккал/моль. Ее обозначают тремя точками. За счет Н-связи молекулы, способные к ее образованию, находятся в ассоциированном состоянии. Это объясняет повышенную температуру кипения и хорошую растворимость низкомолекулярных спиртов. С увеличением гидрофобного радикала R растворимость падает.
Химические свойства. Одноатомные спирты. Их химические свойства обуславливаются, главным образом, присутствием в них реакционноспособной гидроксильной группы. Реакции идут с разрывом связи либо R-OH (реакция SN), либо О-Н (кислотность).
1. При взаимодействии спиртов со щелочными металлами атомы водорода гидрокси-группы замещаются металлом с образованием алкоголята спирта:
2 С2Н5 ¾ ОН + 2Na ® 2C2H5¾ONa + H2
алкоголят (этилат натрия)
Алкоголяты спиртов легко разлагаются водой:
2 C2H5 ¾ ONa + НОН ® С2Н5ОН + NaOH
Эти реакции доказывают слабые кислотные свойства.
2. Спирты взаимодействуют с минеральными и органическими кислотами с образованием соответствующих сложных эфиров и воды:
СН3-СН2-ОН + HOSO3H ® H2O + CH3-CH2-O-SO3H
этилсульфат,
этилсерная кислота,
серноэтиловый эфир
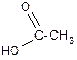
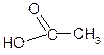
Н+
СН3-СН2-ОН +  Н2О +
Н2О +
этилацетат
3. При действии на спирты водоотнимающих веществ происходит межмолекулярное или внутримолекулярное отщепление воды. Водоотнимающими веществами являются кислоты (конц. H2SO4, H3PO4, щавелевая и др.), оксиды (оксиды алюминия, тория и др.), некоторые соли (сульфат меди, хлористый цинк и др.).
При межмолекулярной дегидратации спиртов получаются простые эфиры (R-O-R):
H2SO4, t°
 СН3-СН2-О-Н + НО–СН3 СН3-СН2-О-СН3
СН3-СН2-О-Н + НО–СН3 СН3-СН2-О-СН3
- Н2О метил-этиловый
эфир
В случае внутримолекулярной дегидратации спиртов, проходящей на тех же катализаторах, но при более высокой температуре, образуются непредельные углеводороды. При этом водород отщепляется от наименее гидрогенизированного атома углерода, находящегося по соседству с углеродом, несущим гидроксильную группу (правило Зайцева):
ОН
½ t°
СН3-СН2-СН-СН3 ® СН3 -СН=СН-СН3 + Н2О
вторичный бутиловый 2- бутен
спирт
Скорость выделения воды возрастает при переходе от первичных к третичным спиртам; последние дегидратируются даже при простой перегонке.
4. Спирты при действии галогенопроизводных фосфора или галогеноводородов превращаются в галогеноалканы:
CH3-CH2-OH + PCl5 ® CH3-CH2-Cl + POCl3 + HCl
хлористый хлорокись
этил фосфора
3 СН3 – СН2-ОН + PCl3 ® 3CH3-CH2-Cl + H3PO3
Реакция спиртов с галогеноводородами обратима:
СН3 – СН2-ОН + HCl 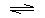 CH3-CH2-Cl + H2O
CH3-CH2-Cl + H2O
Алкилхлориды можно получить и при действии тионилхлорида на спирты:
С2Н5ОН + SOCl2 ® C2H5Cl + SO2 + HCl
5. Спирты окисляются кислородом воздуха в присутствии медных и других катализаторов при 300°–500°С, такими окислителями, как хромовая смесь, перманганат калия и др., а также дегидрируются при 100–180°С над Cu, Ag, Ni и т.д.
Во всех этих случаях первичные спирты дают альдегиды (при дальнейшем окислении – кислоты с тем же числом углеродных атомов), вторичные спирты – кетоны, которые могут быть окислены дальше до двух кислот с разрывом углеродной цепи:
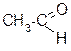 каталитическое
каталитическое

 Н2 +
Н2 +
Дата добавления: 2015-09-28; просмотров: 821;
