Теоретическое введение. В 70-х годах XIX столетия Максвелл в статье для энциклопедии писал: «Атом есть тело, которое нельзя рассечь пополам»
Постулаты Бора
В 70-х годах XIX столетия Максвелл в статье для энциклопедии писал: «Атом есть тело, которое нельзя рассечь пополам». В это же время многие факты указывали на органическую связь электронов с атомами: электролиз (1869), катодные и анодные лучи (1886), фотоэффект (1888), рентгеновские лучи (1895). В 1896 году Беккерель обнаружил существование особых лучей, позднее названных радиоактивным излучением, испускаемым соединением урана. Было доказано, что радиоактивное излучение состоит из α-, β-, γ-лучей. В 1903 Резерфорд и Содди утверждали, что это возможно в результате распада атома.
Изучение атомных спектров сыграло не последнюю роль в познании строения атомов. Прежде всего, обнаруживается, что в спектрах атомов линии располагаются не беспорядочно, а объединяются в группы, их ещё называют серии линий.
Перечисленные выше исследования позволили считать доказанным: внутри атома есть электроны, а силы взаимодействия внутри атомов и молекул - электрического происхождения. Томсон предложил модель атома, согласно которой атом представляет собой равномерно заполненную положительным зарядом сферу, внутри которой находится электрон. Электрон, выведенный из положения равновесия, совершает колебания под действием кулоновских сил.
Чтобы выяснить характер распределения положительных и отрицательных зарядов в атоме, необходимо было непосредственное опытное зондирование внутренних областей атома. Такое зондирование было осуществлено в 1911г. Резерфордом с помощью α-частиц (ионизированных атомов гелия 42Не++ ). Он наблюдал изменение направления полёта α -частиц при прохождении их через тонкие слои вещества. Некоторая часть α-частиц отклонялась на углы 135-150º. Это указывало на то, что представление о положительном заряде атома, «размазанном» по объёму, несостоятельно.
Анализируя результаты опытов, Резерфорд высказал предположение, что положительные заряды как α-частиц, так и рассеивающего атома сосредоточены в малых объёмах, порядка 10-15 м. Остальная часть атома (размерами ≈10-10 м) представляет собой облако отрицательно заряженных электронов, полный заряд которых равен положительному заряду ядра.
В ядерной модели атома электроны не могут быть неподвижны. В результате кулоновских сил притяжения они сразу же упали бы на него. Атому, напротив, свойственна исключительная устойчивость. Устойчивость атома невозможно понять, если ядерную модель объяснять на основе классических законов механики, электричества. Из классической электродинамики следует, что вращающийся электрон должен излучать электромагнитные волны. Теряя свою энергию, электрон должен упасть на протон. Кроме того, по мере приближения к протону линейная и угловая скорости электрона будут увеличиваться. Вследствие этого частота излучения, определяемая частотой обращения электрона вокруг протона, должна была бы непрерывно возрастать. Следовательно, спектр излучения атома должен быть непрерывным, но не линейчатым.
Чтобы объяснить наблюдаемую устойчивость атома водорода и его линейчатый спектр, Бор предложил следующие постулаты:
Постулат стационарных состояний:
1. Электрон в атоме может находиться только на стационарной орбите; при этом он не излучает и не поглощает энергии. Круговые стационарные орбиты определяются условием квантования момента импульса 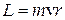 :
:
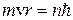 . (n=1, 2, 3,…∞) (9.1)
. (n=1, 2, 3,…∞) (9.1)
Здесь n – номер орбиты, 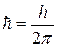 =1.05.10-34Дж.с – постоянная Планка, m – масса электрона, v и r – скорость электрона на орбите соответствующего радиуса. В первом постулате Бора (9.1) прослеживается «насильственное» введение дискретности (разрешены не все орбиты).
=1.05.10-34Дж.с – постоянная Планка, m – масса электрона, v и r – скорость электрона на орбите соответствующего радиуса. В первом постулате Бора (9.1) прослеживается «насильственное» введение дискретности (разрешены не все орбиты).
Правило частот:
2. Излучение (или поглощение) энергии атомом происходит только при переходе электрона с одной орбитына другую. При переходе с одной стационарной орбиты на другую электрон излучает (поглощает) квант света с частотой ν и энергией hν, равной разности энергий стационарных состояний, между которыми произошел переход:
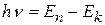 , n>k. (9.2)
, n>k. (9.2)
Этот постулат отражает закон сохранения энергии и гипотезу Планка-Эйнштейна о квантах. Динамика электрона на стационарной орбите определяется уравнениями классической теории. Неизбежное следствие: так как остальные орбиты для электрона запрещены, переход осуществляется скачком; о пути и энергии электрона между орбитами говорить не имеет смысла: законы механики там не применимы.
Опыт Франка и Герца
Из этих представлений следует, что поглощение и излучение энергии атомом должно происходить определёнными дозами. Франк и Герц для проверки этих положений исследовали поглощение энергии атомами при их столкновении с электронами.

В опытах изучались столкновения электронов с атомами газов методом задерживающего потенциала. Идея опытов заключалась в том, что пучок электронов, ускоряемых в электрическом поле, проходил через газ и электроны испытывали соударения с атомами газа. Первые опыты были поставлены на ртути. Схема опытов изображена на рис.9.1. В трубке, заполненной парами ртути под небольшим давлением (≈1 ммрт.ст.), имелись три электрода: катод К, сетка С и анод А. Электроны, вылетавшие из катода вследствие термоэлектронной эмиссии, ускорялись разностью потенциалов U, приложенной между катодом и сеткой. Эту разность потенциалов можно было плавно менять с помощью потенциометра П. Между сеткой и анодом создавалось слабое электрическое поле (разность потенциалов порядка 0.5 В), тормозившее движение электронов к аноду.
Определялась зависимость силы тока I в цепи анода (измерявшейся гальванометром Г)от напряжения U. Полученные результаты представлены на рис.9.2. Сила тока вначале монотонно возрастает, достигает максимума при U = 4.9 В, после чего с дальнейшим увеличением U резко падает, достигает минимума и снова начинает расти. Максимумы силы тока повторяются при U, равном 9.8 В, 14.7 Ви т. д.
Такой ход кривой объясняется дискретностью энергетических уровней. Электроны, встречающие на своем пути атомы ртути, могут испытывать с ними соударения упругие, в результате которых энергия не изменяется, а изменяется лишь направление скоростей электронов, или неупругие, в результате которых электроны теряют энергию, передавая ее атомам ртути. В соответствии с постулатами Бора, атом ртути не может принять энергию в любом количестве; атом может воспринять лишь определенную порцию энергии и перейти при этом в одно из возбужденных энергетических состояний.
Ближайшее к основному состоянию атома ртути отстоит от основного по шкале энергий на 4.86 эВ. До тех пор, пока электроны, ускоряемые полем, не приобретут энергию еU1=4.86 эВ, они испытывают лишь упругие столкновения и анодный ток возрастает с ростом U. Как только кинетическая энергия электронов достигает значения 4.86 эВ, начинают происходить неупругие столкновения. Электрон с таким значением энергии
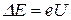 (9.3)
(9.3)
полностью отдает ее атому ртути, не сможет преодолеть задерживающее поле и не достигнет анода. Таким образом, при разности потенциалов между катодом и сеткой, равной 4.86 эВ, должно происходить резкое падение анодного тока.
Аналогичное явление будет происходить при еU2=2.4.86 эВ, … еUn=n.4.86 эВ, когда электроны могут испытать 2, 3 и т.д. неупругих столкновения с атомами ртути, потерять всю свою энергию и не достигнуть анода.
Опыт Франка и Герца показал, что 4.86 эВ – наименьшая возможная порция энергии (наименьший квант энергии), которая может быть поглощена атомом ртути в основном энергетическом состоянии, что и является проявлением дискретности уровней энергии в атоме.
Таким образом, зависимость, приведённая на рис.9.2, подтверждает справедливость первого постулата Бора.
Правило частот Бора также экспериментально подтвердилось в опытах Франка и Герца. Ртутные пары, возбужденные электронным ударом, оказались источником ультрафиолетового излучения с длиной волны λ=253.7 нм. Это излучение происходит в тот момент, когда атом ртути из возбужденного состояния с энергией Е2 возвращается в основное состояние с энергией Е1, излучая фотон с частотой ν:
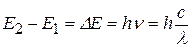 . (9.4)
. (9.4)
Тогда из (9.3) и (9.4) получим:
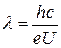 . (9.5)
. (9.5)
По известному значению ΔЕ=еU1=4.86 эВ можно вычислить длину волны излучения: λ=255 нм. Этот результат полностью согласуется с экспериментом: λэксп.=254 нм.
Дата добавления: 2015-09-07; просмотров: 645;
