Нақты газдар.
Идеал газ заңдарын қарастырғанда біз идеал газ молекулаларының сызықтық өлшемдері ескерусіз және молекулалары бір-бірімен өзара әсерлеспейді деп қарастырдық.
1. Идеал газ заңдары – жуықталған заңдар. Олардың ауытқуларында сандық та, сапалық сипаттары бар. Менделеев-Клапейрон теңдеуі 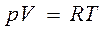 нақты газдар үшін тек жуықталып қана орындалады. Сапалық ауытқуларға келсек, оның сипаты тереңірек жатыр. Нақты газдарды сұйық және қатты күйлерге өткізуге болады. Ал егер газдар Менделеев-Клапейрон теңдеуіне қатаң бағынатын болса, онда бұл мүмкін болмаған болар еді.
нақты газдар үшін тек жуықталып қана орындалады. Сапалық ауытқуларға келсек, оның сипаты тереңірек жатыр. Нақты газдарды сұйық және қатты күйлерге өткізуге болады. Ал егер газдар Менделеев-Клапейрон теңдеуіне қатаң бағынатын болса, онда бұл мүмкін болмаған болар еді.
2. Алыс қашықтықтарда молекулалық күштер тартылыс күштері болып табылады. Бұл тартылыс күштерін нақты газдардың молекулалық теориясының негізін қалаған голланд ғалымының есімімен Ван-дер-Ваальс (1837-1923) күштері деп атайды. Тұтастай алғанда электр бейтерап болатын, элементар зарядтардан түзілген бұл күрделі бөлшектердің арасында тартылыс күштері қалай пайда болуы мүмкін? Мұны түсіну үшін екі жағдайға назар аудару керек. Біріншіден қарама-қарсы зарядтар бөлшек ішінде бір нүктеде жинақталмаған. Осының арқасында олардың сыртқы өрісі өшпейді – кез келген атом немесе молекуланың төңірегінде қашықтық артқан кезде жеткілікті тез өшетін электр өрісі болады. Екіншіден сыртқы өрістің әсерінен молекула ішіндегі зарядтардың орны немесе қозғалысы оң зарядтар өріс бағытында, ал теріс зарядтар – қарсы бағытта ығысатындай болып, сәл-дәл өзгереді. Бұл құбылыс электр поляризация деп аталады. Енді бір-бірінен өте азғантай қашықтықта орналасқан 1 және 2 күрделі бейтерап бөлшектерді қарастырайық: әлі де болса, бірінші бөлшектің екінші бөлшектіңтұрған жерінде тудыратын  өрісінің мәні назар аударалықтай болсын. Осы әсерінен
өрісінің мәні назар аударалықтай болсын. Осы әсерінен  өрістің әсерінен 2 бөлшек полярланады,сөйтіп оның бірінші бөлшек тұрған жеріндегі
өрістің әсерінен 2 бөлшек полярланады,сөйтіп оның бірінші бөлшек тұрған жеріндегі 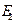 электр өрісі күшееді.
электр өрісі күшееді. 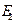 өрістің әсерінен бірінші бөлшек те полярланады, бұл да
өрістің әсерінен бірінші бөлшек те полярланады, бұл да  өрістің күшеюіне әкеп тірейді және т.с.с. Осылардың нәтижесінде бөлшектер бір-біріне қарама-қарсы зарядталған бүйірлерімен бұрылып тұратын болады. Олар бір-біріне қарама-қарсы полюстерімен қарап тұрған магниттер тәрізді тартылатын болады. Қарастырылған күштер дисперсиялық күштер дисперсиялық күштер деп аталады.
өрістің күшеюіне әкеп тірейді және т.с.с. Осылардың нәтижесінде бөлшектер бір-біріне қарама-қарсы зарядталған бүйірлерімен бұрылып тұратын болады. Олар бір-біріне қарама-қарсы полюстерімен қарап тұрған магниттер тәрізді тартылатын болады. Қарастырылған күштер дисперсиялық күштер дисперсиялық күштер деп аталады.
3. Молекулалардың өзара әрекеттесуін 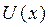 потенциалдық энергиясымен сипаттаған ыңғайлы, бұл функция өзара жақындаған молекулалардың центрлерінің х арақашықтығына тәуелді. Айтылып кеткендерге сай
потенциалдық энергиясымен сипаттаған ыңғайлы, бұл функция өзара жақындаған молекулалардың центрлерінің х арақашықтығына тәуелді. Айтылып кеткендерге сай 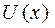 функцияның түрін 2-суреттегідей түрде беруге болады. Оның минимумы бар, онда тартылыс күштері тебілу күштерімен теңгеріседі.
функцияның түрін 2-суреттегідей түрде беруге болады. Оның минимумы бар, онда тартылыс күштері тебілу күштерімен теңгеріседі.
Газдар теориясының көптеген мәселелерінде 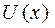 функциясы үшін
функциясы үшін
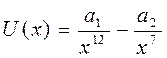
жуықталуын пайдаланады, мұндағы 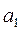 және
және 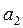 - тұрақтылар. Бұл функция Леннард – Джонс потенциалы деп аталады. Бірінші мүше тебілу күштеріне, ал екінші мүше – Ван-дер-Ваальс тартылыс күштеріне сәйкес келеді. Тартылыс күштері қашықтығының жетінші дәрежесіне кері пропорционал болады. (себебі
- тұрақтылар. Бұл функция Леннард – Джонс потенциалы деп аталады. Бірінші мүше тебілу күштеріне, ал екінші мүше – Ван-дер-Ваальс тартылыс күштеріне сәйкес келеді. Тартылыс күштері қашықтығының жетінші дәрежесіне кері пропорционал болады. (себебі 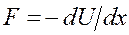 ). Бірінші мүше жай ғана жуықтау деп алуға болады.
). Бірінші мүше жай ғана жуықтау деп алуға болады.
Ван-дер –Ваальстың күй теңдеуі теориясындағы жуықталу бойынша 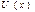 функциясының графигіндегі сол жақтағы тік дерлік көтерілетін учаскесі вертикаль түзумен алмастырылады. Егер d осы түзуден координаттар басына дейінгі қашықтық болса, онда өзара әрекеттесуші бөлшектердің центрлері қашықтықтан кіші қашықтыққа тең бола алмайды, олар бұдан жақынырақ жерге келе алмайды. Қарастырылып отырған жуықталу арасында тартылыс күштері әсер ететін серпімді қатты шарлар моделіне сәйкес келеді. Осы модельді біз пайдаланымыз. Тебілу күштерін ескеру арқылы бір шарлардың мөлшерлерін шектеулі деп санаймыз. Бұл күштер тек соқтығысулар кезінде ғана пайда болады. D қашықтық молекуланың диаметрі рөлін атқарады.
функциясының графигіндегі сол жақтағы тік дерлік көтерілетін учаскесі вертикаль түзумен алмастырылады. Егер d осы түзуден координаттар басына дейінгі қашықтық болса, онда өзара әрекеттесуші бөлшектердің центрлері қашықтықтан кіші қашықтыққа тең бола алмайды, олар бұдан жақынырақ жерге келе алмайды. Қарастырылып отырған жуықталу арасында тартылыс күштері әсер ететін серпімді қатты шарлар моделіне сәйкес келеді. Осы модельді біз пайдаланымыз. Тебілу күштерін ескеру арқылы бір шарлардың мөлшерлерін шектеулі деп санаймыз. Бұл күштер тек соқтығысулар кезінде ғана пайда болады. D қашықтық молекуланың диаметрі рөлін атқарады.
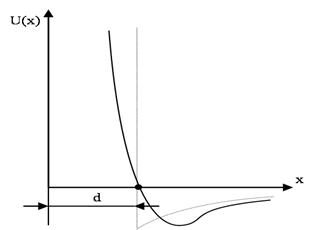
2-cурет
Молекулалардың алып тұрған көлеміне басқа молекулалардың еніп кетуіне қарама-қарсы әсер ететін тебілу күші пайда болады. Сонда нақты газдың еркін қозғала алатын көлемі 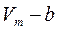 тең болады. Мұндағы b молекулалардың алып тұрған көлемін береді. Ол молекулалардың төрт еселенген
тең болады. Мұндағы b молекулалардың алып тұрған көлемін береді. Ол молекулалардың төрт еселенген 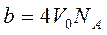 меншікті көлеміне тең. Егер ыдыс ішінде екі молекула орналасса, онда олардың кез-келгені екінші молекуланың ортасына (центріне) a-молекула диаметрінен кіші аралыққа жақындай алмайды. Олай болса, екі молекуланың арасында радиусы d-ға тең болатын сфералық бос көлем пайда болады.
меншікті көлеміне тең. Егер ыдыс ішінде екі молекула орналасса, онда олардың кез-келгені екінші молекуланың ортасына (центріне) a-молекула диаметрінен кіші аралыққа жақындай алмайды. Олай болса, екі молекуланың арасында радиусы d-ға тең болатын сфералық бос көлем пайда болады.
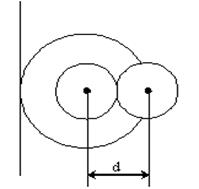
3-cурет
Газ молекулаларының арасында пайда болатын тартылыс күші газға қосымша қысым күшін туғызады. Ол қысымды ішкі қысым 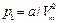 (мұндағы Ван-дер-Ваальс тұрақтысы,
(мұндағы Ван-дер-Ваальс тұрақтысы, 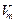 - молярлық көлем).
- молярлық көлем).
Сонда 1 моль нақты газ молекуласы үшін жазылған Бойль-Мариот (PV=RT) теңдеуін нақты газ үшін Ван-дер-Ваальс
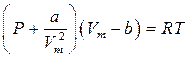 (5)
(5)
ол кез-келген нақты газ мөлшері үшін
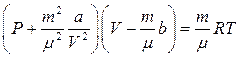 (6)
(6)
мұндағы: m-газдың массасы, m - мольдік массасы, V -газдың алып тұрған көлемі.
Ван-дер-Ваальс теңдеуі бағынатын газдарды Ван-дер-Ваальс газдары деп атайды.
Ван-дер-Ваальс газының изотермасын P-V диаграммасында қарастыру үшін 1 моль нақты газ үшін жазылған (5)-теңдеуін пайдаланады. Ван-дер-Ваальс теңдеуі V көлемге қатысты үшінші дәрежелі теңдеу
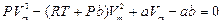 (7)
(7)
Бұл теңдеуге Р қысым параметрі ретінде енеді. Теңдеудің коэффициенттері нақты, заттық (вещественный) болғандықтан теңдеудің бір немесе үш түбірі болады. (заттық немесе бір заттық, екі жорамал түбірі. Физикалық мағынаға тек заттық түбірі ғана ие.) Әрбір түбірі P-V диаграммасында (p=const) изобараның изотерманы қиып өтетін нүктесі сәйкес келеді.
Дата добавления: 2015-09-21; просмотров: 5645;
