Молекуланың еркіндік дәрежесі.
Термодинамикалық әдіс арқылы қарастырылған ойша бөлшектенген макроскопиялық жүйені термодинамикалық жүйе, ал қарастырылып отырған жүйеге енбейтін барлық денелерді сыртқы денелер немесе сыртқы орта деп атайды. Энергия мен зат алмасуы зерттеліп отырған жүйеде іштей де сырттай да жүруі мүмкін. Қарастырылып отырған жүйені сыртқы ортамен оқшаулар әдісіне қарай термодинамикалық жүйені бірнеше түрге: тұйықталған, ашық, жабық, оңашаланған деп бөледі.
Тұйықталған жүйе – бұл массасы өзгеріссіз қалатын жүйе. Тұйықталған немесе ашық жүйе - бұл массасы артып отыратын (сырттан келудің арқасында) жүйе. Көп жағдайда физикада идеалданған тұйықталған жүйелер қарастырылады. Бірақ көптеген жүйелер ашық болады, оларға өсімдіктерді, жан-жануарларды жатқызуға болады. Олар сыртқы ортамен зат алмасып отырады. Егер жүйенің шекаралары арқылы энергия ешбір түрде берілмейтін болса, онда жүйе тұйықталған немесе оңашаланған деп, керісінше жағдайда оқшауланбаған деп аталады.
Егер екі жүйе үшінші жүйемен жылулық тепе-теңдік күйде болатын болса, онда олар бір-бірімен жылулық тепе-теңдік күйде болады. Бұл тұжырымды кейде термодинамикалық нольдік бастамасы деп те атайды.
Денелердің жылулық тепе-теңдікке күйге өтуі кезінде олардың арасында жылу (энергия) алмасу процесі жүреді.
Жүйенің тепе-теңдік күйі Р-қысым, Т –температура, V – көлем, 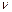 -моль саны тәрізді айнымалылармен анықталады.
-моль саны тәрізді айнымалылармен анықталады. 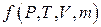 күй функциясы деп атайды. Жұмыс пен энергия термодинамикалық күйді сипаттау үшін пайданылмайды. Белгілі күйдегі жүйенің белгілі жылу мөлшері немесе жұмысы болмайды. Жүйе жұмыс атқарған кезде (газ сығылғанда) немесе жүйеге жылу берілгенде немесе одан жылу алғанда, онда жүйенің күйі өзгереді. Сонымен жұмыс пен жылу жүйені бір күйден екінші күйге өткізетін термодинамикалық процестерге кіреді. Бірақ олар қысым, көлем, температура, маса тәрізді күйдің сипаттамалары бола алмайды.
күй функциясы деп атайды. Жұмыс пен энергия термодинамикалық күйді сипаттау үшін пайданылмайды. Белгілі күйдегі жүйенің белгілі жылу мөлшері немесе жұмысы болмайды. Жүйе жұмыс атқарған кезде (газ сығылғанда) немесе жүйеге жылу берілгенде немесе одан жылу алғанда, онда жүйенің күйі өзгереді. Сонымен жұмыс пен жылу жүйені бір күйден екінші күйге өткізетін термодинамикалық процестерге кіреді. Бірақ олар қысым, көлем, температура, маса тәрізді күйдің сипаттамалары бола алмайды.
Термодинамикалық жүйенің сипаттайтын басты сипаттама оның ішкі энергиясы болып табылады. Ішкі энергия U термодинамикалық жүйені құрайтын микробөлшектерді ілгерілмелі қозғалысының  кинетикалық, осы бөлшектердің өзараәсерлесу энергиясы - потенциалдық энергиясымен айналмалы қозғалысының кинетикалық
кинетикалық, осы бөлшектердің өзараәсерлесу энергиясы - потенциалдық энергиясымен айналмалы қозғалысының кинетикалық  энергияларынан құралады:
энергияларынан құралады:
 (1)
(1)
Ішкі энергия – термодинамикалық жүйенің күйін сипаттайды. Сондықтан ол күй функциясы болып табылады. Термодинамикалық жүйе бір күйден екінші күйге өткенде ішкі энергияның өзгерісі осы күйлердің ішкі энергияларының айырыммен ғана анықталады. Ол термодинамикалық күйлердің бір күйден екінші күйге қандай жолмен өткендігіне тәуелсіз болады.
Ішкі энергия жүйені құрайтын микробөлшектердің еркіндік дәрежесі мен температурасына тәуелді.
Еркіндік дәреже саны – жүйенің кеңістіктегі орнын анықтайтын тәуелсіз айнымалылар саны.
Идеал газ молекулаларының еркіндік дәрежесі
| Еркіндік дәреже саны i | Бір атомды газ | Екі атомды газ | Көп атомды газ |
| 
| 
| |
| Ілгерілмелі | |||
| Айналмалы | - | ||
| Барлығы |
Молекулалардың жалпы еркіндік дәрежесінің санына тәуелсіз үш еркіндік дәрежесі молекулалардың ілгерілмелі қозғалысына сәйкес келеді.
Молекулалардың ілгерілмелі қозғалысының кинетикалық энергиясы
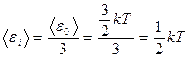 (2)
(2)
Әрбір тербелмелі қозғалыстың еркіндік дәрежесіне сәйкес келетін орташа энергияның мәні kT. Тербелмелі қозғалыстың еркіндік дәрежесіне келетін кинетикалық энергия ілгерілмелі қозғалыстың еркіндік дәрежесіне кинетикалық энергиясы қарағанда екі есе үлкен.
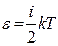 (3)
(3)
мұндағы 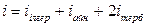 .
.
Классикалық теорияда молекуланы атомдары өзара берік байланысқан жүйе ретінде қарастырады. Олар үшін i молекулалардың еркіндік дәрежесімен сәйкес келеді.
Идеал газдардың молекулалары бір-бірінен әсерлеспейді. Сондықтан олардың потенциалдық энергиялары нольге тең. Қорытындысында бір моль идеал газдың 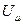 ішкі энергиясы немесе кез келген m массаның ішкі энергиясы сәйкесті
ішкі энергиясы немесе кез келген m массаның ішкі энергиясы сәйкесті
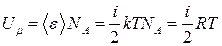 (4)
(4)
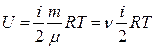 (5)
(5)
мұндағы 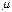 - молярлық масса,
- молярлық масса, 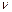 - зат мөлшері, k- Больцман тұрақтысы, R- универсал газ тұрақтысы,
- зат мөлшері, k- Больцман тұрақтысы, R- универсал газ тұрақтысы, 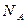 -Авогадро саны, і – молекуланың еркіндік дәрежесінің саны.
-Авогадро саны, і – молекуланың еркіндік дәрежесінің саны.
Классикалық термодинамика негізін термодинамиканың үш бастамасы құрайды. (мысалы классикалық механиканың негізін Ньютон заңдары, ал электродинамика негізін Максвелл теңдеулері құрайтыны сияқты).
Термодинамиканың бірінші бастамасы жүйенің ішкі энергиясының өзгересін жылу мен жұмыспен байланыстырады.
Ол энергияның сақталу мне айналу заңының жылулық қозғалыс үлкен роль атқаратын жүйе жағдайына қолдануы болып табылады.
Жүйе үстінен атқаратын жұмыс – ол сыртқы денелердің термодинамикалық жүйеге берген энергиясымен өлшенеді. Мысалы, газы бар цилиндрдегі поршеньді қозғаған кезде газ сығылып, оның температурасы жоғарылайды. Яғни газдың ішкі энергиясы өзгереді (жоғарлайды).
Жүйеге берілген жылу – термодинамикалық жүйеге сыртқы денелердің жылу алмасуы арқылы берілетін энергиясы. (мысалы, газдың температурасы мен ішкі энергиясын жүйеге белгілі бір жылу мөлшерін температуралары әр түрлі денелер түйіскен кезде ішкі энрегиямен алмасу процесі арқылы өсіруге болады).
Бір денеден екінші денеге энергия екі түрлі формада жұмыс пен энергия түрінде беріледі.
Бұл ұғымдар термодинамикалық жүйе күйлерінің өзгеру процестерімен байланысты ғана белгілі бір мағынаға ие болады. Бұл уақытта ішкі энергия осы жүйенің күй функциясы болып табылады.
Дата добавления: 2015-09-21; просмотров: 9327;
