Термодинамиканың бірінші бастамасы.
Жылуфизикалық процестерді қарастырған кезде өзара байланыстағы сансыз көп денелердің ішінен бір денені, яғни зерттелетін жүйені бөліп алып, ал қалған денелерді сыртқы денелер деп қарастырамыз. Сонда термодинамикалық жүйе тыныштық күйде алынады да, оның барлық энергетикалық өзгерістері оның ішкі энергия өзгерісімен байланыстырылады.
Сонда бұл жүйенің сыртқы ортамен энергия алмасуы жылу берілу немесе жұмыс атқаруы арқылы іске асырылады.
Термодинамикалық жүйеге берілген Q жылу оның ішкі энергиясын өзгертуге 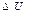 және сыртқы күштерді жеңуге қарсы А жұмыс атқаруға жұмсалады:
және сыртқы күштерді жеңуге қарсы А жұмыс атқаруға жұмсалады:
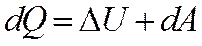 (6)
(6)
Егер жүйе жылуды қабылдаса 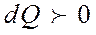 , ал жүйе сыртқы денелер үстінен жұмыс атқарып, оларға энергия берсе, онда
, ал жүйе сыртқы денелер үстінен жұмыс атқарып, оларға энергия берсе, онда 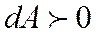 болады. Кейде жүйе жылуды беруі мүмкін
болады. Кейде жүйе жылуды беруі мүмкін 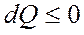 , сонда сыртқы денелердің жұмыс атқаруы нәтижесінде
, сонда сыртқы денелердің жұмыс атқаруы нәтижесінде 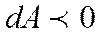 энергия қабылдануы мүмкін. Келтірілген жылу берілуі кезінде әрқашанда жүйенің ішкі энергиясы артады деген ой тумауы керек. Жүйеге жылу берілгенмен, оның ішкі энергиясы артпай, кемуі мүмкін (
энергия қабылдануы мүмкін. Келтірілген жылу берілуі кезінде әрқашанда жүйенің ішкі энергиясы артады деген ой тумауы керек. Жүйеге жылу берілгенмен, оның ішкі энергиясы артпай, кемуі мүмкін ( 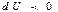 ). Бұл жағдайда (6) теңдеу бойынша
). Бұл жағдайда (6) теңдеу бойынша 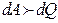 , яғни жүйе алынған жылу
, яғни жүйе алынған жылу 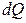 есебінде, ішкі энергия
есебінде, ішкі энергия 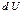 қорының кемуінің есебінде де орындалуы мүмкін.
қорының кемуінің есебінде де орындалуы мүмкін.
Термодинамиканың бірінші заңындағы 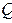 мен А күй функциялары болып табылмайды. Сондықтан оны кейде
мен А күй функциялары болып табылмайды. Сондықтан оны кейде
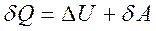 (6а)
(6а)
мұндағы: 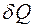 мен
мен 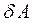 - жылу мен жұмыстың элементар өзгерістері деп атайды.
- жылу мен жұмыстың элементар өзгерістері деп атайды.
Егер қарастырылып отырған сыртқы күштерді жеңу үшін тек механикалық жұмыс жасалатын болса, онда (6) теңдеуін
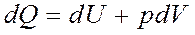 (7)
(7)
Термодинамиканың бірінші бастамасын (заңын) энергияның сақталуы заңы деп те атайды.
Сырттан берілген энергия мөлшерінен артық (көп) жұмыс жасайтын периодты жұмыс жасайтын қозғалтқышты (двигательді) жасауға болмайды.
Бұл тұжырым бірінші текті мәңгілік қозғалтқыш жасауға болмайтындығын дәлелдейді.
Егер жүйе периодты түрде бастапқы орнына қайтып оралатын болса, онда ішкі энергиясының өзгерісі 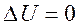 . Онда термодинамиканың бірінші бастамасынан (7) атқарылған жұмыс
. Онда термодинамиканың бірінші бастамасынан (7) атқарылған жұмыс 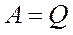 берілген жылу мөлшеріне тең болады.
берілген жылу мөлшеріне тең болады.
Идеал газды ұлғайтқан кездегі орындалатын элементар жұмыс
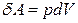 (8)
(8)
Цилиндрдегі поршеньді 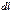 элементар (1-сурет) аралыққа жылжытқан кезде орындалатын жұмыс
элементар (1-сурет) аралыққа жылжытқан кезде орындалатын жұмыс
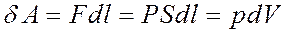
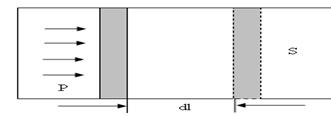
1- сурет
мұндағы: S- поршеннің ауданы, р – қысым, Sdl- жүйенің көлем өзегерісі. Толық жұмыс:
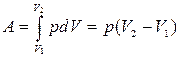 (9)
(9)
Бұл өрнек қатты, сұйық, газ тәрізді денелердің көлемдері ұлғайған жағдайда орындалады.
Термодинамиканың бірінші бастамасын термодинамикалық жүйені сипаттайтын белгілі бір Т-температура, р-қысым, V- көлем тұрақты болатын жағдайларды қолдануды қарастырайық. Бұл келтірілген шарттар орындалатын термодинамикалық күйді термодинамикалық процестер деп атайды.
1) Изотермиялық процесс. Идеал газдың m массасы мен Т температурасы тұрақты болғанда жүретін термодинамикалық процесті – изотермиялық процесс деп атайды (2-сурет).
Термодинамикалық процестерді P-V, P-T, V-T, T-S диаграммаларында көрсету жеңірек болады.
Изотермиялық процесс кезінде газдың ішкі энергияны өзгеріссіз 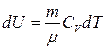 қалады. Сонда жүйеге берілген жылу термодинамиканың бірінші бастамасы бойынша берілген жылу сыртқы күшті жеңу үшін жұмыс атқарады:
қалады. Сонда жүйеге берілген жылу термодинамиканың бірінші бастамасы бойынша берілген жылу сыртқы күшті жеңу үшін жұмыс атқарады:
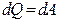 (10)
(10)
Сонда 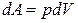 теңдеуіндегі қысымды Менделеев – Клапейрон теңдеуінен анықтауға болады:
теңдеуіндегі қысымды Менделеев – Клапейрон теңдеуінен анықтауға болады: 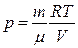
Бұдан
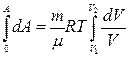
Изотермиялық күйде көлем V1 –ден V2-ге дейін ұлғайған кезде орындалатын жұмыс пен берілген жылу
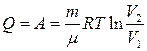 (11)
(11)
Немесе 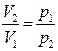 қатынасын пайдалансақ,
қатынасын пайдалансақ,
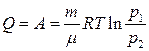 (12)
(12)
жазуға болады.
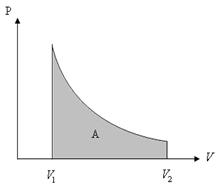
2-сурет
Изотермиялық процес кезіндегі атқарылған жұмыс (2-суреттегі) боялған қисықтың ауданымен өлшенеді. Яғни (12) теңдеуін бір моль идеал газ үшін ( 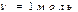 )
)
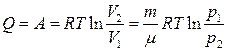 (13)
(13)
жазуға болады.
Изотермиялық процесс кезінде 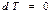 , ал
, ал 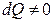 . Алынған процесте
. Алынған процесте 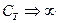 шексіздікке ұмтылады.
шексіздікке ұмтылады.
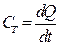 ;
; 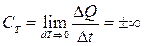
2. Изобаралық процесс. Берілген газдың массасы m=const мен қысымы р=const жағдайда өтетін процесс.(3-сурет)
Күй теңдеуі:
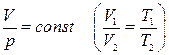
Изобаралық процесс кезінде термодинамикалық жүйе 1 күйден 2 күйге өткенде атқарылған жұмыс  ауданымен есептеледі:
ауданымен есептеледі:
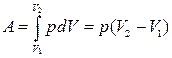 (14)
(14)
Осы (14) теңдеуге Менделеев –Клапейрон теңдеуін пайдалана отырып
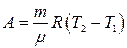 (15)
(15)
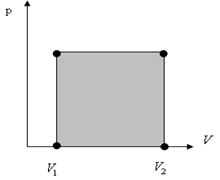
3-сурет
Изотермиялық процесс кезінде атқарылған жұмыс пен температура өзгерісі арасындағы байланысты тағайындауға болады.
Бұд (15) өрнегіне 1 моль газдың температурасын 1К көтеруге кеткен жұмыс A=R әмбебап газ тұрақтысына тең болатындығын да дәлелдеуге болады.
Енді тұрақты қысымдағы жылу сыйымдылық Ср шаманы енгізейік.
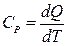
Ал 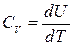 ескерсек, онда термодинамиканың бірінші бастамасы бойынша 1 моль идеал газ үшін
ескерсек, онда термодинамиканың бірінші бастамасы бойынша 1 моль идеал газ үшін
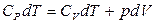 (16)
(16)
Идеал газдың 1 молінің p=const болған кездегі күй теңдеуінен 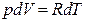 дәлелдеуге болады. Осы өрнектерді ескере отырып, (16) теңдеуін
дәлелдеуге болады. Осы өрнектерді ескере отырып, (16) теңдеуін
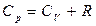 (17)
(17)
Бұл теңдеуді Майер теңдеуі деп атайды. Бұдан 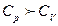 шығады.
шығады.
3) Изохоралық процесс. Берілген газдың m=const мен көлемі V=const жағдайда өтетін термодинамикалық процесті изохоралық процесс деп атайды (4-сурет).
Изохоралық процесте 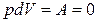 жұмыс атқарылмайды. Жүйеге берілген жылу оның ішкі энергиясын өзгертуге жұмсалады.
жұмыс атқарылмайды. Жүйеге берілген жылу оның ішкі энергиясын өзгертуге жұмсалады.
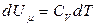 (18)
(18)
Ал кез келген газ массасы үшін
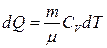 (19)
(19)
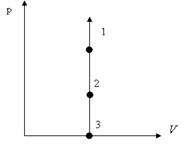
4-сурет
4) Адиабаталық процесс. Қарастырылып отырған термодинамикалық жүйе сыртқы ортамен ешқандай жылу алмаспаса, мұндай жағдайда өтетін процесті адиабаталық процесс деп атайды. Өте тез (жылдам) өтетін, жылуалмасып үлгермейтін процестердің барлығын адиабаталық процеске жатқызуға болады.
Мысалы, ортадағы дыбыстың таралуын, іштен жанатын қозғалтқыштардың ұлғаюы және сығылу цикларды т.б.с.с.
Адиабаталық процесс үшін термодинамиканың бірінші бастамасы ( 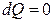 )
)
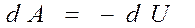 (18)
(18)
Сыртқы күштерге қарсы атқарылатын жұмыс ішкі энергияның кему есебінен орындалады.
Адиабаталық процесс кезінде үш параметрі бір уақытта өзгереді. Ол өзгерістерді Менделеев – Клапейрон 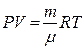 және
және 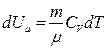 теңдеулерді пайдалана отырып шығарып алуға болады. Сонда
теңдеулерді пайдалана отырып шығарып алуға болады. Сонда
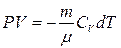 (19)
(19)
немесе Менделеев-Клапейрон теңдеуінен
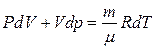 (20)
(20)
табылады.
Термодинамиканың бірінші бастамасын политропты процестерге қолданып, политропия теңдеуін алуға болады.
Бір моль идеал газ үшін
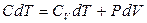 (21)
(21)
Бір моль идеал газ үшін жазылған Менделеев-Клапейрон теңдеуін ( 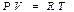 ) дифференциалдап,
) дифференциалдап,
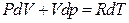 (22)
(22)
Енді (21), (22) біріктіріп шеше отырып, ( 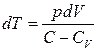 ),
), 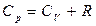 ескеріп,
ескеріп, 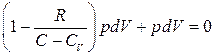
бұдан 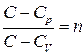 деп белгілеп,
деп белгілеп, 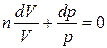 бұл теңдеуді интегралдап,
бұл теңдеуді интегралдап, 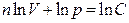 , осы теңдеуден политроптық процесс үшін Пуассон теңдеуі
, осы теңдеуден политроптық процесс үшін Пуассон теңдеуі
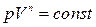 (23)
(23)
немесе 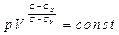 .
.
Егер
1) 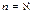 , С=0, адиабаталықпроцесс
, С=0, адиабаталықпроцесс 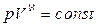
2) 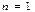 , С=
, С= 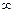 , изотермиялық процесс
, изотермиялық процесс 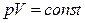
3) 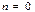 , С=Ср, изобаралық процесс
, С=Ср, изобаралық процесс 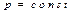
4) 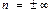 , С=СV, изохоралық процесс
, С=СV, изохоралық процесс 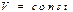
Пуассон немесе адиабата көрсеткіші газ түріне байланысты:
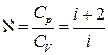
1) Біратомды газ үшін 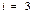 ,
, 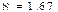
2) Екіатомды газ үшін 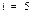 ,
, 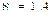
3) Үшатомды және көпатомды газ үшін 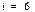 ,
, 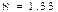
Енді (20) теңдеуін (19) теңдеуіне бөліп, 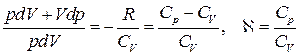 ескере отырып,
ескере отырып,
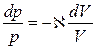 (24)
(24)
Осы (24) теңдеуіне интегралдау және потенциалдау амалдарын орындау, Менделеев-Клапейрон теңдеуін ескере отырып,
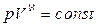
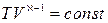 (25)
(25)
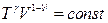
Пуассон теңдеулерін алуға болады.
Адиабаттық процестің PV диаграммасындағы сызбасы изотермиялық процесс сызбасына қарағанда тіктеу жүреді.
Адиабаттық 1-3 сығылу кезінде газдың көлемі азайып қалмайды, оның температурасы жоғарлайды.
Адиабаттық процес кезіндегі процесс кезіндегі жұмыс 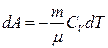 . Егер газ адиабаттық түрде
. Егер газ адиабаттық түрде 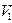 -ден
-ден 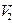 -ге ұлғаятын болса, онда оның температурасы
-ге ұлғаятын болса, онда оның температурасы 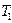 -ден
-ден 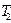 -ге дейін төмендейді:
-ге дейін төмендейді:
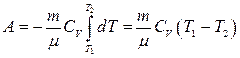
Бұдан
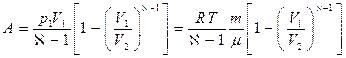 (26)
(26)
Политроптық процесс – тұрақты жылу сыйымдылықта өтеді (С=const). Жоғарыда қарастырылған тенрмодинамикалық процестердің барлығы политроптық процестің дербес түрлері болып табылады.
Жалпы жағдайда жылусыйымдылығы теріс мәнге 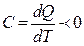 ие болатын процестер жүруі мүмкін. Мұндай жағдайдларда термодинамикалық жүйеде температураның төмендеуі мен жылудың жұтылуы бірге жүреді. Егер
ие болатын процестер жүруі мүмкін. Мұндай жағдайдларда термодинамикалық жүйеде температураның төмендеуі мен жылудың жұтылуы бірге жүреді. Егер 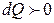 және
және 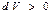 болса, онда жүйеде (газда) жұтылатын жылу мөлшері
болса, онда жүйеде (газда) жұтылатын жылу мөлшері 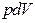 жұмысынан кіші болған жағдайда
жұмысынан кіші болған жағдайда 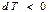 болады да, оған сәйкесті
болады да, оған сәйкесті 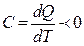 болады.
болады.
Басқаша айтқанда, жылусыйымдылығы теріс мәнге ие болатын процестерде жұмыстық дене берілген жылу есебінен және ішкі энергияның кему есебінен де атқарады екен. Мысалы жүйеде эндотермиялық (жылу жұту) сипаттағы химиялық реакциялар жүрген уақытта жылу сиымдылық 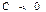 болады.
болады.
Қайтымды термодинамикалық процесс деп жүйенің алғашқы күйіне қоршаған ортаға ешқандай өзгерістер қалдырмай оралуды айтады. Қайтымды процестерге тек тепе-теңдік процестер ғана жатады.
Дата добавления: 2015-09-21; просмотров: 9574;
