Внутренняя энергия. Теплота. Работа. Первый закон термодинамики. Второй закон термодинамики.
Внутренней энергией термодинамической системы называется совокупность всех видов энергии, которыми она обладает, за вычетом энергии поступательного движения ее как целой и потенциальной энергии системы во внешнем поле. Под внутренней энергией U в термодинамике будем понимать энергию теплового движения частиц, образующих систему, и потенциальную анергию их взаимного положения.
Для идеального газа потенциальная энергия взаимодействия молекул считается равной нулю, и внутренняя энергия идеального газа представляет собой только кинетическую энергию теплового движения. Поэтому внутренняя энергия одного моля идеального газа равна: 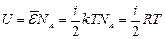 . (1)
. (1)
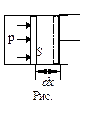
|
Внутренняя энергия системы является однозначной функцией ее состояния. Это означает, что изменение внутренней энергии при переходе из одного состояния в другое не зависит от пути перехода. DU=U2–U1 не зависит от вида процесса, или 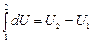 . Здесь dU – полный дифференциал.
. Здесь dU – полный дифференциал.
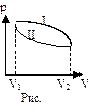
|
Рассмотрим процесс расширения газа. Пусть в цилиндрическом сосуде заключен газ, закрытый подвижным поршнем. Газ, расширяясь, будет перемещать поршень и совершать над ним работу dA=F·dx, где F –сила, с которой газ действует на поршень, р – давление газа в начале пути dx. Следовательно dА = pSdx = pdV, где dV – малое изменение объема газа. Работа, совершаемая при конечных изменениях объема, должна вычисляться путем интегрирования. Полная работа расширения: 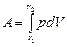
На графике (р,V) работа равна площади фигуры, ограниченной двумя ординатами и функцией p(V).
Первое начало термодинамики выражает закон сохранения энергии для тех макроскопических явлений, в которых одним из существенных параметров, определяющих состояние тел, является температура. Q=DU + А (2)
Уравнение (2) выражает первое начало термодинамики: теплота, сообщенная системе в процессе изменения ее состояния, расходуется на изменение ее внутренней энергии и на совершение работы против внешних сил.
Часто приходится разбивать рассматриваемый процесс на ряд элементарных процессов, каждый из которых соответствует весьма малому изменению параметров системы. Запишем уравнение (2) для элементарного процесса в дифференциальном виде:
dQ=dU+dA, (3)
где dU – малое изменение внутренней энергии; dQ – элементарное количество теплоты; dА – элементарная работа.
Между dU и dQ, dА есть принципиальное отличие. Внутренняя энергия является функцией состояния тела. Поэтому ее изменение зависит только от начального и конечного состояний тела. Работа и количество теплоты зависят не только от этих состояний, но и от способа проведения процесса. Они не являются функциями состояния, а являются функциями теплового процесса.
Если U1=U2 и Q=0, то А=О. Это значит, что невозможен процесс, единственным результатом которого является, производство работы без каких бы то ни было изменений в других телах, т.е. невозможен перпетуум мобиле – вечный двигатель первого рода.
· Первое начало термодинамики при изохорическом процессе (V=const; dV=0, dA=pdV=0): 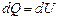 – теплота, сообщаемая системе при изохорическом процессе, идет на изменение внутренней энергии. При этом работа не совершается.
– теплота, сообщаемая системе при изохорическом процессе, идет на изменение внутренней энергии. При этом работа не совершается.
· Первое начало термодинамики при изобарическом процессе (p=const):
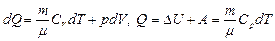 .
.
· Первое начало термодинамики при изотермическом процессе (Т=const; dT=0; 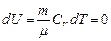 ):
): 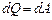 – теплота, сообщаемая системе при изотермическом процессе, идет на работу против внешних сил.
– теплота, сообщаемая системе при изотермическом процессе, идет на работу против внешних сил.
Первое начало термодинамики не дает никаких указаний относительно направления, в котором могут происходить процессы в природе. С точки зрения первого начала любой мыслимый процесс, не противоречащий закону сохранения и превращения энергии, может быть реализован в природе. Например, если имеются два тела, температуры которых различны, то по первому началу термодинамики не противоречил бы переход теплоты от тела с более низкой температурой к телу с температурой более высокой. Единственным ограничением, налагаемым первым началом на этот процесс, является требование, чтобы количество теплоты, отданной одним телом, было равно количеству теплоты, полученной вторым.
О направлении процессов, происходящих в действительности, позволяет судить второе начало термодинамики.
Формулировка Клаузиуса: Тепло не может самопроизвольно переходить от менее нагретого к более нагретому телу без каких-либо изменений в системе. Из этого определения не вытекает, что тепло не может передаваться от менее нагретого к более нагретому телу. Это происходит в любых холодильных установках, но передача тепла здесь не является конечным результатом, так как при этом совершается работа.
Формулировка Томсона (Кельвина): Невозможно преобразовать в работу всю теплоту, взятую от тела с однородной температурой, не производя никаких других изменений в состоянии системы. Здесь не вытекает, что теплота не может быть полностью обращена в работу. Например, при изотермическом процессе (dU=0) теплота полностью обращается в работу, но этот результат не является единственным, конечным, так как здесь еще происходит расширение газа.
Видно, что приведенные формулировки эквивалентны.
Второе начало термодинамики был окончательно сформулирован тогда, когда окончились неудачей все попытки создать двигатель, который бы обращал в работу всю полученную им теплоту, не вызывая при этом никаких других изменений состояния система - вечный двигатель второго рода. Это двигатель, имеющий к.п.д. 100 %. Поэтому другая формулировка второго начала термодинамики: невозможен перпетуум мобиле второго рода, т.е. такой периодически действующий двигатель, который получал бы тепло от одного резервуара и превращал эту теплоту полностью в работу.
Дата добавления: 2015-09-21; просмотров: 1569;
