МКТ. Основное уравнение кинетической теории газов. Газовые законы. Уравнение Менделеева-Клапейрона.
Основным уравнением кинетической теории газов называется соотношение, связывающее давление (величину, измеряемую на опыте) со скоростью или кинетической энергией молекулы идеального газа.
В молекулярно-кинетической теории пользуются идеализированной модельюидеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Скорости частиц как по модулю, так и по направлению могут быть любыми, изменение их происходит непрерывно.
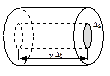
|
Рассмотрим одноатомный идеальный газ. Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами очень мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие. Выделим на стенке сосуда элементарную площадку Ds (cм. рис.). При каждом соударении, молекула, движущаяся перпендикулярно площадке, передает ей импульс т0 v–(–m0 v) = 2 т0 v,
где т0 — масса молекулы, v – ее скорость. За время Dt площадки Ds достигнут только те молекулы, которые заключены в объеме цилиндра с основанием Ds и высотой vDt. Число этих молекул равно nDsvDt, где п – концентрация молекул. Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлений, так что в любой момент времени вдоль каждого из них движется 1/3 молекул, причем половина из них (1/6) движется вдоль данного направления в одну сторону, половина – в противоположную. Тогда число ударов молекул, движущихся в заданном направлении, о площадку Ds будет 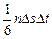 . При столкновении с площадкой эти молекулы передадут ей импульс:
. При столкновении с площадкой эти молекулы передадут ей импульс: 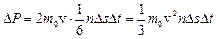
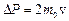 .
.
Тогда давление газа на стенку сосуда: 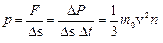 (1)
(1)
Если газ в объеме V содержит N молекул, движущихся со скоростями v1, v2., то учитывают среднюю квадратичную скорость: 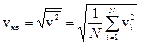 (2), характеризующую всю совокупность молекул газа. Уравнение (1) с учетом (2) примет вид
(2), характеризующую всю совокупность молекул газа. Уравнение (1) с учетом (2) примет вид 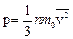 . (3)
. (3)
Данное выражение называется основным уравнением молекулярно-кинетической теории идеальных газов. Оно устанавливает связь между давлением и среднеквадратичной скоростью.
Введем Е 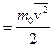 – среднюю кинетическую энергию хаотического поступательного движения одной молекулы, тогда основное уравнение запишется как:
– среднюю кинетическую энергию хаотического поступательного движения одной молекулы, тогда основное уравнение запишется как: 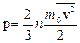 или
или 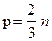 Е.
Е.
Здесь давление связано со средней энергией поступательного движения молекул. При переходе к равновесию от одной части газа к другой передается энергия. Выравнивается не энергия всего газа как целого, а средняя кинетическая энергия, отнесенная к одной молекуле. Температура газа пропорциональна средней кинетической энергии его молекул: Т ~ Е. Средняя кинетическая энергия поступательного движения молекулы Е = 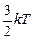 , (4)
, (4)
где k - постоянная Больцмана, : k=1,38.10-23 Дж/К, Т – температура, выраженная в кельвинах. Из формулы (4) следует, что абсолютная температура является мерой средней кинетической энергии поступательного хаотического движения молекул. Подставляя в (3) это выражение, получим, что давление идеального газа связано с температурой соотношением:
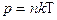 .
.
Давление определяется только концентрацией (при постоянной температуре) и не зависит от сорта молекул.
Газовые законы устанавливают связь между двумя параметрами состояния при постоянном третьем параметре для данной массы газа.
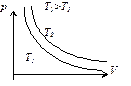
|
Экспериментальное исследование свойств газов, проведенное в ХVII-XVIII вв. Бойлем, Мариоттом, Гей-Люссаком, Шарлем, привело к формулировке газовых законов (с учетом представления абсолютной температуры)
1. Изотермический процесс. pV=const – уравнение изотермы.
Чем выше изотерма, тем более высокой температуре она соответствует, T2>T1.
2. Изобарный процесс. 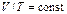 – уравнение изобары. Чем ниже к оси температуры наклонена изобара, тем большему давлению она соответствует, р2 > p1.
– уравнение изобары. Чем ниже к оси температуры наклонена изобара, тем большему давлению она соответствует, р2 > p1.
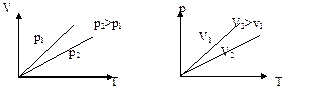
3. Изохорический процесс. 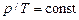 – уравнение изохоры. График зависимости р от Т изображен на рис 7.3. Чем ниже к оси температуры наклонена изохора, тем большему объему она соответствует, V2 > V1.
– уравнение изохоры. График зависимости р от Т изображен на рис 7.3. Чем ниже к оси температуры наклонена изохора, тем большему объему она соответствует, V2 > V1.
Комбинируя выражения газовых законов, получим уравнение, связывающее р, V, Т (объединенный газовый закон): 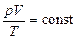 .
.
Постоянная в этом уравнении определяется экспериментально. Для количества вещества 1 моль газа она оказалась равной R=8,31 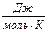 и была названа универсальной газовой постоянной.
и была названа универсальной газовой постоянной.
1 моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. Число молекул (структурных единиц) в 1 моле равно числу Авогадро: NA=6,02.1023моль-1. Для R справедливо соотношение: R=k NA. Итак, для одного моля: 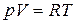 . Для произвольного количества газа n=m/m(m - молярная масса газа.):
. Для произвольного количества газа n=m/m(m - молярная масса газа.): 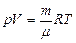 ,
,
уравнение Менделеева-Клапейрона.
Дата добавления: 2015-09-21; просмотров: 2249;
