ОСНОВЫ ТЕХНИЧЕСКОЙ ТЕРМОДИНАМИКИ
Параметры состояния термодинамической системы. Уравнение состояния рабочего тела.
В качестве рабочего тела в тепловых машинах используют газы и пары, обладающие способностью легко и быстро расширяться или сжиматься.
Физическое состояние рабочего тела определяется время основными параметрами состояния: температурой, давлением и удельным объемом.
Температура характеризует степень нагретости тела и измеряется в градусах. В настоящее время используются три температурные шкалы: абсолютная или термодинамическая шкала – Т, К, практическая международная шкала – t, °С, шкала Ференгейта – t, °F.
Термодинамическая шкала установлена по температуре абсолютного нуля и тройной точки воды, равной 273,16 К, при которой могут существовать одновременно лед, вода и пар. Эту шкалу называют еще и абсолютной, так как температура измерения по ней не зависит от свойства теплоносителя. Цена деления шкалы в градусах Цельсия совпадает с ценой деления шкалы Кельвина (I К = I °С).
Численные значения температуры, определяемые по этим шкалам связаны соотношением:
Т, К = t, °С + 273,15, 1.1
По шкале Фаренгейта, применяемой в Англии и США, температура плавления льда 32 °F и температура кипения воды при нормальных физических условиях (р 0 =I0I325 Па, Т0=273,15 К) равна 2120 F следовательно
t°C= 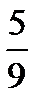 ∙(t°F32) , 1.2
∙(t°F32) , 1.2
Давление – это сила, действующая по нормали на единицу поверхности.
p = 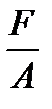 , 1.3
, 1.3
где F – сила , нормальная к поверхности и равномерно распределенная по поверхности площадью А.
Единицей давления в системе СИ является Паскаль (1 Па=1Н/м2).
Очень часто в технике для практических измерений используют высоту столба жидкости. В основном применяется в качестве жидкости вода, спирт или ртуть. Полезно вспомнить, что при 0°C или 273,16 К.
I мм вод. ст.= 9,81 Па I мм рт. ст.= 133,3 Па
За параметр состояния в термодинамике принимают абсолютное давление.
Абсолютное давление обычно, подчитывается по показаниям двух приборов.
Если давление больше атмосферного, то оно измеряется манометром и абсолютное давление равно
pа=pб+pи, 1.4
где pб – атмосферное давление, измеренное барометром;
pи – показание манометра, измеряющего избыточное давление,
Если pб 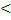 pа , то pа=pб-pв, 1.5
pа , то pа=pб-pв, 1.5
где pв – показание вакуумметра, измеряющего разряжение.
Удельный объем тела:
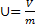 , 1.6
, 1.6
где v- удельный объем, м3/кг;
V – полный объем, м3;
m – масса тела, кг.
Величина, обратная удельному объему называется плотностью вещества:
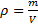 , 1.7
, 1.7
где 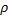 - масса единицы, кг/м3.
- масса единицы, кг/м3.
Уравнение состояние тела устанавливают зависимость между параметрами состояния. Для идеального газа уравнение состояния выражается законом Клапейрона:
Для 1 кг газа
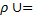 R0∙T, 1.8
R0∙T, 1.8
Для m кг газа:
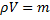 ∙R0∙T. 1.9
∙R0∙T. 1.9
Для моля идеального газа уравнение предложено Менделеевым и имеет вид
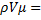 =М∙R0∙Т=R∙T, 1.10
=М∙R0∙Т=R∙T, 1.10
где V – объем моля газа, м3/кмоль;
R0 – газовая постоянная, Дж/(кгК);
М – молекулярная масса, кг/кмоль;
R – универсальная газовая постоянная; её значение для всех газов 8314,3 Дж/(кмоль∙К)
При нормальных физических условиях любой килограмм-моль газа занимает объем V=22,4 м3/кмоль. Поэтому для вычисления их удельного объема в м3/кг при этих условиях можно использовать зависимость
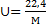 , 1.11
, 1.11
Газовая постоянная отдельного газа определяется по выражению
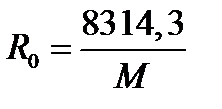 , 1.12
, 1.12
Объем газа V, находящегося при произвольных физических условиях ( 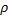 и Т) может быть приведен к нормальным физическим условиям (
и Т) может быть приведен к нормальным физическим условиям ( 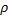
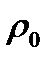 ) по формуле
) по формуле
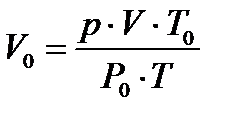 , 1.13
, 1.13
Значения удельной газовой постоянной, молекулярной массы и плотности при нормальных условиях для наиболее распространенных газов приведены в таблице 1.1
Таблица 1.1 Значение М, R0 и 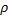 0 при нормальных условиях некоторых газов.
0 при нормальных условиях некоторых газов.
| Наименование газа | Химическое обозначение | Молекулярная масса М, кг/кмоль | Удельная газовая постоянная R0, Дж/(кг∙К) | Плотность при нормальных ф. у. ρ0, кг,м3 |
| Воздух | - | 28,96 | 287,0 | 1,293 |
| Кислород | О2 | 32,00 | 259,68 | 1,429 |
| Азот | N2 | 28,03 | 269,8 | 1,251 |
| Аммиак | NH3 | 17,03 | 488,3 | 0,771 |
| Аргон | Az | 39,99 | 208,2 | 1,783 |
| Атмосферный воздух | - | 28,16 | (295,3) | (1,257) |
| Водород | Н2 | 2,02 | 4124,0 | 0,090 |
| Водяной пар | Н 2О | 18,02 | (461,0) | (0,804) |
| Гелий | На | 4,00 | 0,179 | |
| Окись углерода | СО | 28,01 | 296,8 | 1,260 |
| Двуокись углерода | СО2 | 44,01 | 188,9 | 1,907 |
| Сернистый газ | 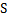 О2 О2
| 64,06 | 129,0 | 2,926 |
| Метан | СН4 | 16,03 | 518,8 | 0,51 |
| Этилен | С 2Н4 | 28,05 | 296,6 | 1,251 |
| Коксиный газ | - | 11,50 | 721,0 | 0,515 |
Примечание:
1. Атмосферный азот – углекислый газ, состоящий из азота воздуха вместе с двуокисью углерода и редкими газами, содержащимися в воздухе.
2. Приведение водяного пара к нормальному состоянию является условным.
Дата добавления: 2015-09-18; просмотров: 921;
