РЕЧОВИНИ
Методичні вказівки
Для підготовки до лабораторних робіт
З курсу хімії
Частина 1
Миколаїв 2000
УДК 041
Камінська Є.Г., Кельїна С.Ю.Методичні вказівки для підготовки до лабораторних робіт з курсу хімії. Частина 1. - Миколаїв: УДМТУ, 2000. – 48 с.
Кафедра хімії
Ці вказівки містять короткі довідки, необхідні для виконання лабораторних робіт. Окрім того, розібрані методи розв’язку задач з відповідних тем та запропоновані вправи і задачі для самостійної підготовки та самоконтролю знань.
Вказівки призначені для студентів усіх спеціальностей.
Спис.літ. – 5 назв.
Рецензент канд.техн.наук., доц. Матвієнко В.М.
Ó Український державний морський
технічнийуніверситет, 2000
Лабораторна робота № 1
ГАЗОВІ ЗАКОНИ І МЕТОДИ ВИЗНАЧЕННЯ МОЛЯРНОЇ МАСИ
РЕЧОВИНИ
Багато хімічних процесів відбуваються в газовій фазі, тому більшість методів визначення молярних мас сполук засновані на використанні газових законів.
Моль – кількість речовини, яка містить стільки атомів, молекул, іонів, електронів або інших структурних одиниць, скільки атомів міститься в 12 г ізотопу 12C. Число структурних одиниць, яке міститься в 1 молі речовини (стала Авогадро), дорівнює 6,02.1023 моль-1.
Масу 1 моля речовини називають молярною або мольною масою; вона виражається в г/моль і чисельно дорівнює відносній молекулярній або атомній масі речовини. Кількість молей n розраховується за формулою n = m/M, де m - маса речовини, М - молярна маса. Наприклад, в 1 молі речовини кисню O2 і елемента Оксигену міститься одна і та ж кількість структурних одиниць – в першому випадку 6,02.1023 молекул O2 , в другому - 6,02.1023 атомів O. Але мольна маса O2 дорівнює 32 г/моль, а маса 1 моля атомів O - 16 г/моль. Наведемо ще приклади: 2 моля CaSO4 містять 2.6,02.1023 молекул, їх маса - m (CaSO4) = 2.136 = 272 г; 2 моля атомів S містять 2.6,02.1023 атомів і мають масу 64 г.
Стан газу характеризується його тиском, температурою і об’ємом. Зв’язок між ними встановлюють закони ідеальних газів.
Закон Бойля–Маріотта: PV = const(m = const, T = const).
Закон Гей-Люсака–Шарля: V/T = const (m = const, P = const).
Закон Гей-Люссака: P/T = const (m = const, V = const).
Закон Дальтона: при однаковій температурі компонентів газової суміші загальний тиск газової суміші (Р) дорівнює сумі парціальних тисків окремих газів (рі): Р = р1 + р2 + … .
Закон Авогадро: в рівних об’ємах різних газів за однакових умов (тиску і температурі) міститься однакова кількість молекул.
Закон Авогадро має два наслідки:
1. Молярна маса газу або пари дорівнює добутку відносної густини даного газу за іншим та молярної маси іншого газу. Відносною густиною першого газу за другим (D2) називається відношення мас однакових об’ємів першого газу і другого газу за однакових умов, тобто
D2 = m1/m2 = nМ1/ nМ2 = M1/M2; M1 = D2/M2.
Найчастіше відносна густина визначається за воднем або за повітрям:
М1 =DН2. М(Н2) = 2DН2; М1 = Dпов. M(пов) = 29Dпов; ( М(пов) = 29 г/моль).
2. Один моль будь-якого газу за нормальних умов займає об’єм 22,416 л. Цей об’єм називають молярним об’ємом газу.
Нормальні умови ( о ) – це Т°= 273 К, Р° = 101325 Па.
Параметри стану газу Р, V, Т пов’язані з його масою m і молярною масою М рівнянням стану ідеального газу Менделєєва-Клапейрона:
РV = (m/M) RT ,
де R - універсальна газова стала, яка визначається для 1 моля газу з виразу :
R = P°V°/T°
В залежності від використаних одиниць R має різні чисельні значення:
R = 8,31 Дж/(моль.К) (Система Інтернаціональна - СІ) = 0,0821 л . атм/(моль.К) = =62360 мл . мм рт.ст./(моль. К) = 1,987 кал/(моль. К).
Молярну масу газоподібних речовин можна визначити наступними способами:
а) Визначення молярної маси за відносною густиною.
Приклад 1. Визначити молярну масу газу, якщо 1,5 г цього газу за однакових Р і Т займають той самий об’єм, що й 0,1 г водню.
Розв’язок:
1. DН2- ? DН2= m (газ)/m(H2) = 1,5/0,1 = 15.
2. М (газ) - ? Використовуючи наслідок з закону Авогадро, запишемо:
М (газ) = 2 DН2= 2.15 = 30 г/моль.
Відповідь: молярна маса газу дорівнює 30 г/моль.
Приклад 2. Визначити густину за воднем газової суміші, яка складається з 50 % кисню та 50 % водню за об’ємом.
Розв’язок:
1. М(суміші) - ?
Об’ємна доля дорівнює мольній долі, тому молярну масу суміші можна розрахувати за формулою:
М(суміші) = М1N1 + М2N2 = М(О2).N(О2) + М(Н2) .N(Н2), де N(H2) i N(O2) – мольні долі газів у суміші; М(суміші) = 32.0,5 + 2.0,5 =17(г/моль).
2. D Н2- ?
DН2=М(суміші)/М(Н2) =17/2 = 8,5
Відповідь: густина суміші за воднем дорівнює 8,5.
б) Визначення молярної маси за мольним об’ємом.
Приклад 3. Визначити молярну масу газу, якщо маса 600 мл його дорівнює 1,714 г за н.у.
Розв’язок:
1. М(газ) - ? Використовуючи наслідок з закону Авогадро, складаємо пропорцію:
1,714 г газу займають 600 мл;
х г газу займають 22400 мл;
х = (22400 . 1,714)/600 = 63,9 г.
Оскільки 22400 мл це – мольний об’єм газу, М(газ) = 63,9 г/моль.
Відповідь: М(газ) = 63,9 г/моль.
в) Визначення молярної маси газу за законом Менделєєва-Клапейрона.
Приклад 4. Визначити молярну масу бензолу, якщо маса 600 мл його пари при 87°С і тиску 83,2 кПа дорівнює 1,30 г.
Розв’язок:
Виразимо всі дані в одиницях СІ:
Р = 8,32 104 Па; Т = 273 + 87 = 300 К; V = 6 10-4 м3; m = 1,3 10-3 кг.
1. М(С6Н6) - ?
Використовуємо закон Менделєєва-Клапейрона: РV = (m/M).RT, звідки
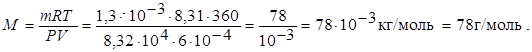
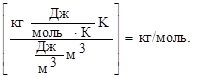
Відповідь: молярна маса бензолу дорівнює 78 г/моль.
Питання і задачі
1. Дати визначення "моль речовини".
2. Сформулювати закон Авогадро та наслідки з нього.
3. Дати визначення "відносна густина одного газу за другим".
4. Записати рівняння стану ідеального газу і розрахувати значення R у різних одиницях.
5. Записати способи визначення молярної маси газу.
6. Визначити кількість молей і кількість атомів, які містяться у: 32 г кисню, 14 г азоту, 8 г кисню, 10 г водню.
7. Скільки молей атомів Нітрогену містять 1 моль нітратної кислоти; 2 моля амоніаку; 2 моль амоній нітрату?
8. Які необхідні експериментальні дані, щоб визначити молярну масу газу всіма відомими вам способами?
9. Визначити густину за воднем газової суміші, яка складається з 70 % карбон (ІІ) оксиду та 30 % карбон (ІV) оксиду за об’ємом.
10. За нормальних умов 500 мл газу мають масу 1,806 г. Визначити його відносну густину за повітрям і молярну масу.
11. Визначити масу 1м3 сульфур (ІV) оксиду при температурі 27 °С і тиску 3 атм.
12. В закритій посудині знаходиться 200 г кисню під тиском 3,5 атм і при
температурі 7°С. Визначити масу СО2 в цьому об’ємі при температурі 27°С під тиском 2,8 атм.
Дата добавления: 2015-09-18; просмотров: 1025;
