ЕКВІВАЛЕНТУ МАГНІЮ
Стехіометричні закони визначають кількісні співвідношення реагуючих речовин і базуються на атомно-молекулярному вченні. Однак більшість твердих неорганічних сполук не мають молекулярної структури. В їх кристалічних гратках неможливо відокремити молекули, тому формою існування таких хімічних сполук є фаза. Фазою називається сукупність частин системи, однакових за складом і властивостями і відокремлених від інших частин поверхнею розділу. До таких структур відносяться іонні, металічні й атомні гратки. Це треба враховувати при формулюванні стехіометричних законів.
Закон сталості складу. Склад молекулярної сполуки не залежить від способу її одержання. При відсутності молекулярної структури в даному агрегатному стані склад сполуки залежить від умов добування.
Наприклад, склад амоніаку не залежить від способу одержання (NH4Cl ® NH3 + HCl; 3H2 + N2 ® 2NH3), а склад ферум (ІІ) оксиду – залежить, і його можна виразити формулою Fe1-хО, де х = 0,1 – 0,2.
Закон кратних відношень. Якщо два елементи утворюють між собою декілька молекулярних сполук, то масові кількості одного елемента, які припадають на одну й ту ж масову кількість другого елемента, відносяться між собою як невеликі цілі числа. Наприклад, для кисневмісних сполук Карбону СО2 та СО співвідношення кількостей кисню дорівнює 2:1. Для сполук, які не мають молекулярної структури, у загальному випадку ці кількості можуть відноситися між собою як дробові числа. Наприклад, відношення масових долей Оксигену, які припадають на одну масову долю Титану в оксидах титану ТіО0,58-1,33, ТіО1,46‑1,56, ТіО1,9-2,0, є дробовими числами.
Закон еквівалентів. Молекулярні сполуки реагують у кількостях, пропорційних їх еквівалентам. При відсутності молекулярної структури у даному агрегатному стані їх кількості можуть відхилятися від хімічних еквівалентів.
Хімічним еквівалентом (еквівалентом) речовини (Е) називають таку її кількість, яка поєднується з одним молем атомів Гідрогену, або заміщує таку ж кількість атомів Гідрогену у хімічних реакціях. Розмірність еквівалента – моль. Наприклад, Е(О) = 0,5 моля, оскільки Оксиген у бінарній сполуці Н2О поєднується з двома молями атомів Гідрогену.
Молярною масою еквівалента речовини (МЕ) називається маса одного еквівалента речовини. Розмірність еквівалентної маси – г/моль. Наприклад, МЕ(О) = 8 г/моль.
Для молекулярних сполук закон еквівалентів виражається співвідношенням
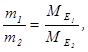
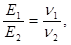
де m1 i m2 – маси реагуючих речовин, МЕ1 і МЕ2– їх еквівалентні маси, Е1 та Е2 − еквіваленти речовин, ν1, ν2 − кількості їх молей.
Приклад 1. Визначити еквівалент і еквівалентну масу Сульфуру в Н2S.
Розв’язання:
1. Е(S) - ?, МЕ (S) - ?
У дигідроген сульфіді H2S 2 моля атомів Гідрогену сполучаються з 1 молем атомів Сульфуру або 1 моль атомів Гідрогену сполучається з 0,5 моля атомів Сульфуру. Згідно з визначенням, еквівалент Сульфуру Е(S) дорівнює 0,5 моля, а еквівалентна маса МЕ(S) = 0,5 .32 = 16 г/моль.
Відповідь: Е(S) – 0,5 моля, МЕ(S) – 16 г/моль.
Еквівалент і еквівалентну масу елемента можна визначити за складом його сполуки з іншим елементом, еквівалент якого відомий.
Приклад 2. При згорянні 5 г металу утворюється 9,44 г оксиду металу. Визначити еквівалентну масу металу.
Розв’язання:
1. m(O) у оксиді - ?
m(O) = m(окс) – m(Ме) = 9,44 – 5,0 = 4,44 (г)
2. МЕ(Ме) – ?
Еквівалентна маса Оксигену дорівнює 8 г/моль. Згідно з законом еквівалентів складемо рівняння:
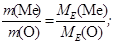
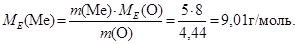
Відповідь: молярна маса еквівалента металу дорівнює 9,01 г/моль.
Для розрахунків еквівалентів та молярних мас еквівалентів складних речовин можна використати наступні співвідношення:
Е(реч) = 1/f, моль, МЕ (реч) = М(реч)/f, г/моль, де f − фактор еквівалентності
а) МЕ (кисл) = М(кисл)/f. У цьому випадку f дорівнює кількості іонів Н+, що обмінюються.
В реакції H2SO4 + NaOH ® NaHSO4 + H2O еквівалент H2SO4 дорівнює одному молю, а еквівалентна маса МЕ (H2SO4) = 98 г/моль.
б) МЕ(осн) = М(осн)/f, де f дорівнює кількості іонів ОН−, що обмінюються.
В реакції Al(OH)3 + H2SO4 ® Al(OH)SO4 + 2H2O еквівалент Al(OH)3 дорівнює 0,5 моля, а МЕ(Аl(ОН)3) = 39 г/моль.
в) МЕ (солі) = М(солі)/f, де f = n∙m, де n – кількість катіонів, що обмінюються, m – їх валентність.
В реакції NaH2PO4 + 2NaOH ® Na3PO4 + 2H2O еквівалент NaH2PO4 дорівнює 0,5 моля, а МЕ (NaH2PO4) = 60 г/моль.
г) МЕ (оксиду) = М(окс)/f, де f = n∙m, де n – число атомів другого елемента (не Оксигену), m – його валентність.
Еквівалент Аl2О3 = М(Аl2О3)/ 2.3 = 1/6 моль, а МЕ (Аl2О3) = 17 г/моль.
е) Еквівалентна маса елемента у сполуках визначається з співвідношення МЕ(ел) = А/f, де А – атомна маса елемента, f = n – його валентність у сполуці. Наприклад, МЕ(О) = 16/2 = 8 г/моль.
ж) Еквівалентна маса сполуки складається з еквівалентних мас складових.
Наприклад, MЕ(MgSO4) = ME(Mg2+) + ME(SO42-) = 12 + 49 = 61 (г/моль).
Наведені приклади показують, що еквівалент речовини залежить від реакції, в якій вона бере участь.
В деяких випадках корисно користуватися значенням еквівалентного об¢єму, тобто об’єму, який займає за даних умов 1 еквівалент газової речовини. VЕ (реч) = VM(реч)/f
Так, еквівалентний об’єм водню за н.у. VE(H2) дорівнює 11,2 л/моль (тому що 1 моль атомів Н складає 0,5 моля Н2, а 1 моль Н2 займає об’єм 22,4 л за н.у.), кисню - 5,6 л/моль.
Приклад 3. Визначити атомну масу двовалентного металу, якщо 8,34 г металу окиснюються 0,68 л кисню (н.у.).
Розв’язання:
МЕ(Ме) - ?
Знаходимо МЕ(Ме) з співвідношення:
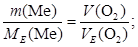
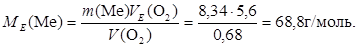
2. А (Ме) - ?
МE(ел) = A/n, A = МE (ел). n = 68,8 . 2 = 137,6 г/моль.
Відповідь: атомна маса металу дорівнює 137,6 г/моль.
Питання і задачі
1. Сформулюйте стехіометричні закони. Вкажіть відхилення від них.
2. Що називається еквівалентом? Що таке еквівалентна маса?
3. Чому дорівнюють еквіваленти елементів Гідрогену і Оксигену? Який об`єм займає один еквівалент простих речовин водню і кисню?
4. Сформулюйте закон еквівалентів. Дайте його математичний вираз.
5. Як можна розрахувати еквівалентну масу оксиду? Кислоти? Основи? Солі? Елемента?
6. Визначте еквівалентну масу Н3РО4 і Сu(ОН)2 в таких реакціях:
a) H3PO4 + 3KOH ® K3PO4 + 3H2O;
б) H3PO4 + 2KOH ® K2HPO4 + 2H2O;
в) Cu(OH)2 + 2HCl ® CuCl2 + 2H2O;
г) Cu(OH)2 + HCl ® CuОНCl + H2O.
7. Визначте еквівалентну масу сполук: CuSO4.5H2O, CrCl3, Cr2(SO4)3, KAl(SO4)2, Na2SO4.7H2O, Na2HPO4.12H2O.
8. Визначте еквівалентну масу металів у сполуках: CuSO4.5H2O, Cr2O3, KCr(SO4)2, Ni(OH)2, K2CO3, Mg3(PO4)2.
9. Знайти еквівалентну й атомну масу двовалентного металу, якщо 0,53 г його витіснять з кислоти 520 мл при 16 °С загальному тиску газової суміші (Н2 + Н2О) 99700 Па (748 мм рт. ст.). Тиск насиченої водяної пари 1800 Па (13,5 мм рт. ст.).
10. Знайти еквівалентну масу металу, якщо при взаємодії 7,2 г його з хлором було отримано 28,3 г солі. Еквівалентна маса хлору 35,5 г/моль.
11. Скільки літрів водню (н.у.) необхідно на відновлення 56 г оксиду металу, який має 71,43 % металу? Чому дорівнює еквівалентна маса металу?
Дата добавления: 2015-09-18; просмотров: 2901;
