Ковалентні зв’язки
1.Пептидні зв’язки – (- СО – NH -) виникають внаслідок взаємодії карбоксильних та 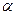 - аміногруп амінокислот, що утворюють пептидний ланцюг.
- аміногруп амінокислот, що утворюють пептидний ланцюг.
2.Дисульфідні зв’язки (- S – S -) – утворюються між залишками молекул цистеїну, що входять до одного або різних пептидних ланцюгів.
2.Нековалентні зв’язки та слабкі взаємодії – фізико – хімічні зв’язки, що беруть участь у взаємодії як певних частин одного пептидного ланцюга, так і різних, близько розташованих ланцюгів, утворюючи вищі рівні конформації білкових молекул.
1.Водневі зв’язки – виникають між двома електронегативними атомами за рахунок атома Гідрогену, ковалентно зв’язаного з одним із електронегативних атомів. Вони найчастіше утворюються між Гідрогеном, що входить до складу груп = NH, - OH, - SH та сусіднім атомом Оксигену, наприклад:
= N – H … O = C =
2. Йонні зв’язки – зв’язують між собою йонізовані амінні та карбоксильні групи.
3. Дипольні зв’язки – електростатичні взаємодії постійних чи індукованих диполів, які можуть виникати між радикалами полярних амінокислот (серину, цистеїну, тирозину тощо), що входять до складу білкових молекул.
4.Гідрофобні взаємодії – слабкі взаємодії. Що виникають між бічними радикалами таких амінокислот, як валін, лейцин, ізолейцин тощо за рахунок їх „виштовхування” з полярної (звичайно, водної) фази.
Первинна структура білків
Під первинною структурою білків розуміють послідовність сполучення залишків амінокислот у поліпептидному ланцюгу. У поняття первинної структури білка або пептиду входять його якісний та кількісний склад та порядок чергування окремих амінокислотних залишків. Порядок хімічного сполучення амінокислотних ланок – найбільш істотна причина різноманітності білків. Наприклад, для білка, в кому міститься лише 10 залишків різних амінокислот, можливе існування 3 628 800 ізомерів, які відрізняються порядком сполучення амінокислотних ланок.
Дата добавления: 2015-09-18; просмотров: 1661;
