ІІІ рівень. 6.З 100 молекул електроліту про дисоціювало 30
6.З 100 молекул електроліту про дисоціювало 30. Ступінь дисоціації даного електроліту становить:
а) 3%; б) 0,3%; в) 30%; г) 5%.
7. Ступінь електролітичної дисоціації електроліту дорівнює 15%. Яке число молекул розпалося на йони, якщо у розчині було 5 000 молекул?
а) 500; б) 75; в) 1500; г) 750.
8. Скласти рівняння дисоціації таких сполук: калій фосфату, натрій ацетату, барій гідроксиду, алюміній нітрату, ортофосфатної кислоти, натрій силікату.
Позааудиторна самостійна робота № 8
Тема: Гідроліз солей
План
1.Поняття про гідроліз та його біологічну роль.
2.Випадку гідролізу солей.
3.Виконання тренувальних вправ.
Час виконання:2 години
Мета роботи:ознайомитися з випадками гідролізу солей та навчитися визначати реакцію середовища у розчині будь – якої солі.
У хімічній практиці часто доводиться зустрічатися із такими фактами, коли розчини різних середніх солей, що не містять у своєму складі ні йонів Гідрогену, ні гідроксид-йонів, виявляють кислотну, лужну або нейтральну реакцію середовища. Ці факти пояснюються процесом гідролізу, тобто взаємодією солі з водою. Характер перебігу реакції гідролізу солей визначається природою даної речовини.
Гідроліз – це оборотний процес взаємодії йонів слабкого електроліту, які входять до складу солі, з водою, що призводить до утворення нового слабкого електроліту.
З процесами гідролізу і розчинення пов’язано підтримання на постійному рівні кислотності крові та інших фізіологічних рідин. Дія медичних препаратів, що належать до солей, теж зумовлена їх кислотно – основними властивостями, здатністю до гідролізу за умов фізіологічного середовища організму. Гідролітичні процеси слід враховувати і при зберіганні медикаментів та їх призначенні у комплексі з іншими лікарськими засобами.
Будь – яку сіль можна уявити як продукт взаємодії кислоти і основи. Наприклад, амоній хлорид NH4Cl – слабкою основою NH4OH і сильною кислотою HCl, а натрій нітрат NaNO3 – сильною основою NaOH і сильною кислотою HNO3.
Для визначення рН середовища середньої солі необхідно враховувати, за яким йоном відбувається гідроліз даної солі. За величинами констант гідролізу можна обчислити рН розчинів солей, якщо відома концентрація солі. Розглянемо кілька прикладів:
1.Гідроліз солі, утвореної сильною основою і слабкою кислотою, відбувається за аніоном:
An- + HOH 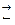 HAn + OH-
HAn + OH-
CH3COONa + H2O → CH3COO- + Na+ + H+ + OH- → CH3COOH + Na+ + OH-
Середовище лужне, рН > 7 
2.Гідроліз солі, утвореної слабкою основою і сильною кислотою, відбувається за катіоном:
Kt+ + HOH 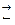 KtOH + H+
KtOH + H+
NH4Cl + H2O → NH4+ + Cl- + H+ + OH- → NH4OH + Cl- + H+
Середовище кисле, pH<7
3.Гідроліз солі, утвореної слабкою основою і слабкою кислотою, відбувається і за катіоном, і за аніоном. Гідроліз солей, утворених слабкими багатоосновними кислотами або слабкими багатокислотними основами відбувається ступінчасто. У першому випадку продуктами гідролізу є кислі солі, у другому – основні солі.
CH3COONH4 + H2O → CH3COO- + NH+4 + H+ + OH- → CH3COOH + NH4OH
Середовище нейтральне, рН = 7 
4.Гідроліз солі, утвореної сильною кислотою і сильною основою не відбувається:
NaCl + H2O → → Na+ + Cl- + H+ + OH-
Середовище нейтральне, pH=7
Для кількісного оцінювання оборотного процесу гідролізу солей використовують поняття ступінь гідролізу h:
h = 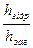 ∙100%
∙100%
Ступінь гідролізу зростає зі зменшенням концентрації розчину солі, підвищенням температури. Він також залежить від природи солі. Чим слабкішою є кислота (чи основа), що утворюється внаслідок гідролізу, тим більшою мірою гідролізує сіль.
Дата добавления: 2015-09-18; просмотров: 1331;
