Позааудиторна самостійна робота № 7
Тема: Сильні та слабкі електроліти
План
1. Поняття про електроліти, їх роль у життєдіяльності організму.
2. Класифікація електролітів за їх ступенем дисоціації.
3. Поняття про активність йонів та константу дисоціації.
Час виконання: 1 година
Мета роботи: на основі теорії електролітичної дисоціації ознайомитися з сильними та слабкими електролітами.
Усі хімічні сполуки за їх здатністю проводити електричний струм поділяють на електроліти і неелектроліти.
Електроліти – це речовини, які проводять електричний струм як у розплавленому стані, так і в розчинах. До них належать деякі основи та солі, які в твердому стані складаються з йонів , наприклад КСІ, СаСІ2, КОН, NaOH, LiF та ін., і речовини, що утворюють йони при розчиненні їх у воді (амоніак, хлороводень, органічні кислоти тощо). У воді електроліти дисоціюють на йони, які взаємодіють як з водою, так і між собою.
Електроліти відіграють дуже велику роль у життєдіяльності організму, тому що всі фізіологічні рідини (шлунковий сік, плазма крові, позаклітинна, внутрішньоклітинна, спинномозкова рідини, секрети залоз) є розчинами електролітів. З наявністю цих сполук пов’язане певне значення осмотичного тиску та рН середовища біорідин. Електроліти здатні утримувати воду у вигляді гідратів, протидіючи зневодненню організму. Концентрація електролітів і фізіологічних рідинах впливає на розчинність білків, амінокислот та низькомолекулярних сполук.
Отже, для розуміння багатьох біологічних явищ необхідно знати закономірності, яким підлягають розчини електролітів.
Для будь – якої оборотної хімічної реакції можна записати математичний вираз її константи рівноваги в загальному вигляді:
aA + bB 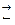 cC + dD
cC + dD
Kp = 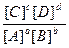
Електролітичною дисоціацією називають розщеплення сполуки на йони внаслідок її взаємодії з розчинником.
Кількісною характеристикою процесу електролітичної дисоціації є ступінь дисоціації 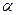 та константа дисоціації Кд.
та константа дисоціації Кд.
Ступенем дисоціації електроліту називають відношення числа молекул, що про дисоціювали, до загального числа молекул електроліту:
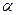 = n/N, або
= n/N, або 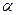 = Сдис/С0, де n – число дисоційованих молекул, N – загальне число молекул електроліту, Сдис і С0 – концентрація молекул, що розпались на йони, і вихідна концентрація електроліту (моль/л).
= Сдис/С0, де n – число дисоційованих молекул, N – загальне число молекул електроліту, Сдис і С0 – концентрація молекул, що розпались на йони, і вихідна концентрація електроліту (моль/л).
Дата добавления: 2015-09-18; просмотров: 1357;
