Позааудиторна самостійна робота № 6
Тема: Способи вираження кількісного складу розчинів
План
1. Поняття про масову, мольну та об’ємну частку розчиненої речовини.
2.Молярна, моляльна концентрації.
3.Молярна концентрація еквівалента. Фактор еквівалентності та його обчислення.
4.Поняття про титр розчину.
5.Розрахункові формули для переходу від одного способу вираження складу розчину до іншого.
6.Виконання тренувальних вправ і задач.
Час виконання: 3 години
Мета роботи: ознайомитися із способами вираження складу розчинів; навчитися розв’язувати розрахункові задачі по даній темі.
Важливою характеристикою розчину є його кількісний склад, тобто вміст розчиненої речовини у певній кількості розчину або розчинника. Склад розчину можна виразити як часткою розчиненої речовини так і концентрацією розчиненої речовини.
Концентрацією розчиненої речовини (не розчину!) називають відношення кількості або маси розчиненої речовини до об’єму розчину. Концентрація – це відношення неоднотипних фізико – хімічних величин.
Способи вираження концентрації залежать від одиниць виміру кількості розчину, розчиненої речовини (В) і розчинника (А).
1.Масова частка розчиненої речовини В ( ω) – це відношення маси розчиненої речовини m( В) до загальної маси розчину m р-ну:
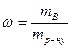 · 100%
· 100%
2. Мольна частка розчиненої речовини ( NB) – це відношення кількості речовини компонента В (νB ) до загальної кількості всіх компонентів розчину:
NB = 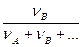
3. Об’ємна частка розчиненої речовини (φB ) – це відношення об’єму розчиненої речовини ( ) до суми об’ємів всіх компонентів розчину:
φB = 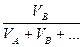
4.Молярна концентрація (СМ) – це відношення кількості розчиненої речовини νВ до об’єму розчину Vр-ну, вираженого у кубічних дециметрах (літрах):
CM = 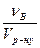 =
= 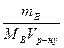
5. Моляльна концентрація (Сm) – це відношення кількості розчиненої речовини νB до маси розчинника mА, вираженої у кілограмах:
Cm =  =
= 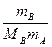
6.Молярна концентрація еквівалента (Секв) – це відношення кількості речовини еквівалентів розчиненої речовини νекв до об’єму розчину Vр-ну , вираженого у кубічних дециметрах (літрах):
Секв = 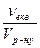 =
= 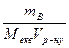
Молярна маса еквівалента Мекв речовини В дорівнює добутку її молярної маси МВ (г/моль) на фактор еквівалентності fекв.
Фактор еквівалентності показує, яка частка моля речовини реагує (еквівалентна) з одним молем атомів Гідрогену в певній кислотно – основній реакції або одному електрону в цій або відповідній окисно – відновній реакції.
Молярна маса еквівалента кислоти дорівнює її молярній масі, поділеній на основність, тобто на число атомів Гідрогену в молекулі кислоти. Наприклад, молярна маса еквівалента сульфатної кислоти дорівнює Мекв (H2SO4) = 98г/моль : 2= 49 г/моль.
Розчини однакової молярної концентрації еквівалента реагують між собою в однакових об’ємних співвідношеннях. Між об’ємом розчину та його молярною концентрацією еквівалента існує обернено пропорційна залежність:
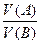 =
= 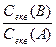
7. Титр розчину (Т) виражають масою розчиненої речовини В (у грамах) що міститься в 1 мл розчину (1 см3):
Т = 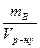
Між титром і молярною концентрацією еквівалента є залежність:
Т = 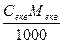
Часто доводиться виконувати перерахунок концентрації розчинів з одних одиниць в інші. Це можна швидко зробити, використовуючи наведені нижче формули.
Рівняння для перерахунку масової частки компонента в молярну концентрацію або молярну концентрацію еквівалента мають такий вигляд:
СМ(В) = 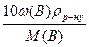
Секв(В) = 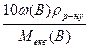
Для переходу від молярної концентрації до молярної концентрації еквівалента і навпаки користуються формулами:
СМ = Секв 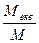
Секв = СМ 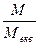
Приклад 1.У воді розчинили 8 г натрій гідроксиду. Об’єм розчину довели до 500 мл. Знайти молярну концентрацію NaOH у розчині.
Дано:
m(NaOH) = 8 г; Яка молярна концентрація NaOH?
V(р –ну) = 500 мл . CM = 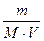 =
= 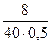 = 0,4 моль/л
= 0,4 моль/л
Знайти:
СМ(NaOH) -? Відповідь: розчин 0,4 М
Приклад 2.Знайти молярну концентрацію сульфатної кислоти в розчині масою 150 г, з масовою часткою H2SO4 20% і густиною 1,139 г/мл
Дано:
m(р –ну) = 150 г; 1.Скільки грамів H2SO4 міститься у розчині?
W(H2SO4) = 20%; mp.p. = 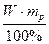 =
= 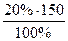 = 30 г
= 30 г
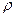 = 1,139 г/мл 2. Який об’єм займе розчин?
= 1,139 г/мл 2. Який об’єм займе розчин?
Знайти: V = 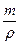 =
= 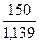 = 131,7 мл = 0,1317 л.
= 131,7 мл = 0,1317 л.
СМ(H2SO4) - ? 3. Яка молярна концентрація розчину?
M(H2SO4) = 98 г/моль CM = 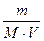 =
= 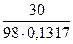 = 2,325 моль/л
= 2,325 моль/л
Відповідь: СМ розчину дорівнює 2,325 М.
Приклад 3.Обчислити молярну концентрацію еквівалента 500 г 10 % розчину натрій карбонату. Густина розчину 1,115 г/мл.
Дано:
m(р –ну) = 500 г; 1. Знаходимо молярну масу еквіваленту Na2CO3:
W(Na2CO3) = 10%; Мекв = 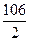 =53 г/моль
=53 г/моль
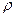 = 1,115 г/мл 2.Яка маса Na2CO3 міститься у 500 г розчину?
= 1,115 г/мл 2.Яка маса Na2CO3 міститься у 500 г розчину?
Знайти: mp.p.= 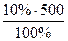 = 50 г
= 50 г
Секв(Na2CO3) - ? 3. Який об’єм займе розчин?
V = 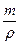 =
= 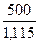 = 448 мл = 0,448 л
= 448 мл = 0,448 л
4.Яка молярна концентрація еквівалента розчину?
Секв = 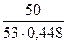 = 2,1 г/л
= 2,1 г/л
Відповідь: Секв(Na2CO3) = 2,1 н.
Дата добавления: 2015-09-18; просмотров: 1801;
