Кристаллическое строение металлов
Металлы это группа элементов, расположенная левее галлия, индия и талия, а не металлы – правее мышьяка, сурьмы, висмута. У металлов в узлах решетки расположены протоны (ионы), между протонами расположены электроны не прочно связанные с ними. У металлов на наружных оболочках расположены один - три электрона, у неметаллов много электронов пять - восемь. При соединении металлы отдают свои электроны не металлическим материалам, заряжаясь положительно. Неметаллы заряжаются отрицательно.
В технике под металлом понимают вещества, обладающие металлическим блеском, пластичностью, ковкостью, электропроводимостью. Металлические сплавы, состоящие из 2-х и более элементов, называются металлическими, так как обладают теми же свойствами. С повышением температур у всех металлов и сплавов электропроводимость уменьшается, с понижением температуры - увеличивается, достигая у некоторых металлов сверхпроводимость.
Металловедение – наука, изучающая строение и свойства металлов и сплавов, устанавливает связь между их составом, строением и свойствами.
Всякое вещество может находится в трех агрегатных состояниях – твердом, жидком и газообразном. Переход происходит при определенных температурах, давлении и сопровождается резким изменение свойств. Это происходит из – за изменения расположения атомов, их взаимного притяжения, увеличения движения электронов.
В твердых телах порядок расположения атомов определенный, закономерный, относительно жесткий. В жидком состоянии атомы, молекулы хотя и сохраняют «ближний порядок», но их движение хаотичное под действием тепла. В газах нет закономерности расположения атомов, молекул, электронов. Частицы под действием температуры двигаются хаотически, стремятся занять больший объем. В физике кристаллическое состояние и твердое состояние – синонимы. Теория - гипотеза Федорова в том, что в кристаллах атомы расположены закономерно в узлах решетки, а между ними облако общих электронов, подтверждается экспериментально при использовании рентгеновских лучей, электронных микроскопов. С 1990 –1995г. стало возможным манипулировать с единичными молекулами, атомами, с появлением сканирующих, туннельных, атомно - силовых микроскопов.
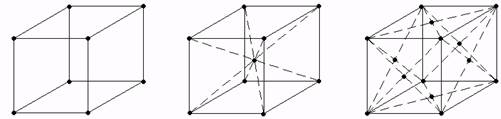
Простейшим типом кристаллической решетки является кубическая решетка, в которой 8 атомов (ионов), упакованы не плотно. Расстояние между атомами измеряется в ангстремах 1А0=10-8 см.; координационное число этой решетки равно 6 (К6).
Стремление атомов (ионов) металлов и сплавов занимать наиболее близкое расстояние между собой приводит к образованию решеток других типов. В результате могут образоваться следующие решетки (рис.1)
Кубическая объемно-центрированная: ОЦК К=8
Кубическая гранецентрированная: ГЦК. К=12
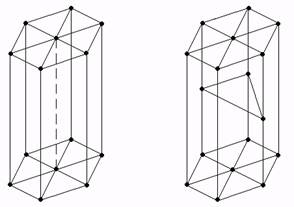
Гексагональная: Г К=6
Гексагональная плотноупакованная: ГПУ К=12
Размеры кристаллической решетки характеризуются параметрами или периодами решетки, которые обозначаются «а», «с». Число атомов находящихся на наиболее близком расстоянии от данного атома, называется координационным числом и обозначается буквой «К». Чем больше «К» тем более плотная упаковка атомов в кристаллической решетке.
а б в
г д
а – кубическая;
б – кубическая объемноцентрированная;
в – кубическая гранецентрированная
г – гексагональная
д – гексагональная плотноупакованная
Рисунок 1 – Основные типы кристаллических решеток
Необходимо помнить, что каждый металл обладает определенной кристаллической решеткой, которая у большинства металлов не перестраивается при повышении (понижении) температуры. У некоторых металлов (Fe, Co, Mn, Ti, Sn, Zr,U), решетка меняется под влиянием температур, давления. Это явление называется полиморфизмом или аллотропией и обозначается буквами 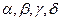 и т.д. Изменение строения решетки приводит к изменению физико – химико – механических свойств (плотность, способность растворять другие элементы). Для металлов типичны решетки ОЦК, ГЦК, ГПУ с большим координационным числом.
и т.д. Изменение строения решетки приводит к изменению физико – химико – механических свойств (плотность, способность растворять другие элементы). Для металлов типичны решетки ОЦК, ГЦК, ГПУ с большим координационным числом.
Для неметаллов координационное число имеет значение  4, поэтому они обладают меньшей плотностью, удельным весом.
4, поэтому они обладают меньшей плотностью, удельным весом.
Дата добавления: 2015-09-18; просмотров: 1420;
