Кристаллизация металлов, фазовые превращения
Любое вещество, любой элемент может находится в трех агрегатных состояниях: твердом, жидком, газообразном. Только углерод может находится в двух состояниях твердом и газообразном.
Температура плавления металлов, сплавов важная константа. У каждого вещества, элемента она своя. определённая. У чистых металлов температура перехода из твердого состояния в жидкое точечная, у сплавов состоящих из 2-х и более компонентов в отдельных зонах имеется интервал расплавления, т.е. начало и конец плавления.
Есть специальные таблицы, справочники, где можно найти данные о температурах плавления, кипения, плотности металла и другие физические константы.
При переходе из жидкого состояния в твердое в металле образуются кристаллы, возникают кристаллические решетки. Этот процесс называется кристаллизацией.
Для начала кристаллизации необходимы условия, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии. Для начала кристаллизации необходимо переохлаждение металла, для расплавления – перегревание металла. На рисунке 7 показаны кривые охлаждения при кристаллизации. Величиной или степенью переохлаждения называют разность между теоретической и фактической температурами кристаллизации. Видно, что жидкость охлаждается и температура доходит до горизонтальной площадки (скрытая теплота кристаллизации). По окончании кристаллизации температура снова начинает снижаться и твердое вещество охлаждается.

Рисунок 7 –Кривые охлаждения при кристаллизации
Механизм процесса кристаллизации состоит в следующем (рис. 8):
- вначале зарождаются мельчайшие частички зародышей кристаллов на границе раздела фаз или мелких неметаллических включениях (центрах кристаллизации);
- далее кристаллики начинают расти, сталкиваясь в процессе роста друг с другом. По мере развития процесса образуется все больше кристаллов.
Скорость всего процесса кристаллизации определяется:
- скоростью зарождения центров кристаллизации;
- скоростью роста кристаллов, которая в свою очередь определяется степенью переохлаждения.
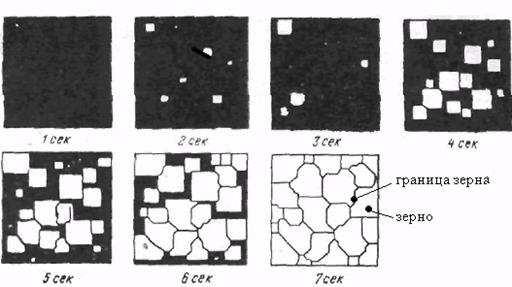
Рисунок 8 –Модельное представление о процессах кристаллизации (И.Л. Миркин)
Форма кристаллических образований, как показал Д.К. Чернов, состоит из дендридов рисунки 9 и 10.

Рисунок 9 – Схема дендрита Д. К. Чернова

Рисунок 10 – Кристалл Чернова (х⅓)
При кристаллизации первостепенное значение имеют:
- скорость и направление отвода тепла;
- наличие неметаллических дисперстнейших частиц;
- наличие конвективных токов;
- интервал переохжладения.
Строение закристаллизовавшегося слитка описано впервые Черновым Д. К. (рис.11). Видно, что он состоит из: а) наружной мелкозернистой зоны дезориентированных мелких кристаллов, б) зоны столбчатых кристаллов дендритной формы, в) зоны крупных равноосных кристаллов, г) усадочной раковины, д) конуса осаждения.
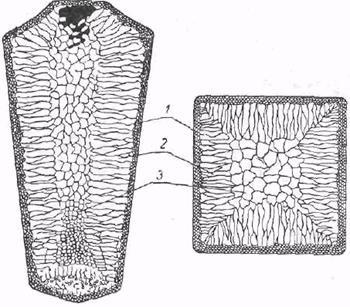
Рисунок 11 – Схема строения стального слитка
В зоне мелких кристаллов металл наиболее плотен, в зоне столбчатых кристаллов металл так же плотен, содержит мало раковин, газовых пузырей, однако в стыках кристаллов имеет пониженную прочность. В слитках, особенно легированных сталей, может встречаться транскристаллизация, когда дендриты кристаллов вырастают на всю длину радиуса. Транскристаллизация зависит от химсостава сплава, перегрева, сечения слитка, температуры стенок изложниц. Усадочная раковина образуется за счет разности удельных весов жидкого и твердого металла, высокой температуры, наличия газов и неметаллических включений.
В процессе обработки металла давлением зерно измельчается, изменяется его форма, сечение, длина, материал уплотняется. Механические свойства повышаются.
В ряде случаев металл может иметь разные решетки, при разных температурах. Этот процесс называется полиморфизмом (аллотропией). Для металлургов важна главным образом температурная аллотропия в твердом состоянии. Аллотропические превращения сопровождаются поглощением (выделением) тепла и происходят при постоянной температуре или в интервале температур. На рисунке 12 показана кривая охлаждения железа. С отрицательных температур до 911 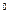 С железо находится в форме Feα, с 911
С железо находится в форме Feα, с 911 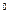 С до 1392
С до 1392 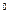 С – в форме Fγ, с 1392
С – в форме Fγ, с 1392 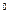 С до 1539
С до 1539 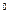 С – в форме Fe
С – в форме Fe 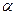 1, (Fe
1, (Fe 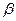 ), выше 1539
), выше 1539 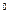 С железо находится в жидком состоянии. При температуре выше 768
С железо находится в жидком состоянии. При температуре выше 768 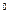 С железо становится немагнитным. Новые аллотропические формы образуются в результате перекристаллизации одной твердой фазы в другую в результате зарождения центров кристаллизации, зародышей кристаллов и их роста.
С железо становится немагнитным. Новые аллотропические формы образуются в результате перекристаллизации одной твердой фазы в другую в результате зарождения центров кристаллизации, зародышей кристаллов и их роста.
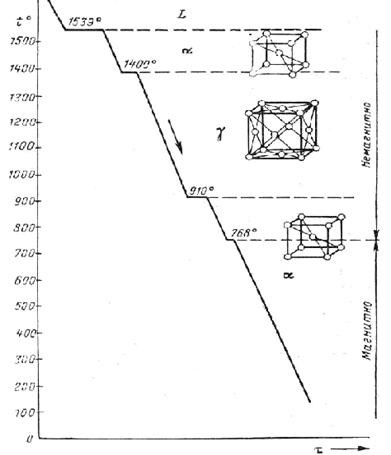
Рисунок 12 – Кривая охлаждения железа
Твердые растворы – это фазы, в которых один из компонентов сохраняет свою кристаллическую решетку, а атомы другого (других) располагаются в решетке первого компонента.
Имеются растворы замещения и внедрения. В растворах замещения атом (ион) растворителя замещается растворяющим атомом. Внедряться в растворитель могут элементы, имеющие малый радиус атома (C, N, B, H и др.). Атомы элемента внедряющегося в растворитель нередко скапливаются у дислокаций, искажений решетки.
В растворах могут образовываться так же химические соединения, которые имеют свои решетки и определенные физико-химические свойства. Формула химсоединения в общем виде выглядит АnBm. В диаграмме Fe-C имеется химсоединение Fe3С, в диаграмме Al-Cu химсоединение CuAl2 и т.д Образование химсоединений сопровождается тепловым эффектом.
В процессе кристаллизации литых заготовок, слитков происходит процесс ликвации элементов. Ликвация – это процесс изменения химического состава металла по сечению литой заготовки. Вначале кристаллизации выпадают кристаллы металла более чистые, более тугоплавкие. Оставшийся раствор обогащается элементами, растворенными в основном металле. Особенно сильно ликвируют следующие элементы С, P, S, H, N,O и др. Наблюдается ликвация дендритная (в зернах металла), по всему сечению литой заготовки, ликвация по плотности компонентов. Чтобы уменьшить или разсосредоточить ликвацию необходимо уменьшить сечение литой заготовки, не перегревать сплав, быстро его охлаждать, производить диффузионный отжиг, многократно перековывать металл.
Дата добавления: 2015-09-18; просмотров: 1831;
