ПОПОЛНЕНИЕ ЗАПАСОВ ХОЛЕСТЕРИНА В ОРГАНИЗМЕ ИЗ ПИЩИ И ЗА СЧЕТ ЭНДОГЕННОГО СИНТЕЗА
Из пищи усваивается холестерин, поступающий только с продуктами животного происхождения. В желудочно-кишечном тракте человека b-ситостерол - стероид, широко распространенный в растениях, практически не всасывается.
Эфиры холестерина, поступающие в организм с пищей, гидролизуютсяхолестеролэстеразой панкреатического или кишечного сока. Продукты гидролиза всасываются эпителием кишечника в видесмешанных мицелл.
Экзогенный или синтезированный клетками кишечника холестерин частично превращается в эфиры. Этот процесс включает две стадии: 1. активацию жирной кислоты под действиемацил-КоА-синтетазы; 2. перенос ацильного остатка ацил-КоА на НО-группу холестерина, который катализирует ацилхолестеролацилтрансфераза (АХАТ).
В клетках слизистой оболочки кишечника эфиры холестерина, свободный холестерин, ресинтезированные ТАГ и синтезированные энтероцитами алипопротеины В-48, A-I и A-II упаковываются в хиломикроны, которые первоначально поступают в лимфу, а затем - в кровь.
В кровотоке хиломикроны контактируют с ЛВП и получают от них белки: апоС-П и апоЕ. В обратном направлении из хиломикронов в ЛВП поступают апоА-1 и апоА-II. В результате этого обмена хиломикроны превращаются в зрелые частицы, способные связываться с липопротеинлипазой. Входящие в состав хиломикронов ТАГ расщепляются под действием липопротеинли-к, прикрепленной к стенкам капилляров, и из хиломикронов образуются остаточные хиломикроны.
Остаточные хиломикроны удаляются из кровяного русла печенью по механизму эндоцитоза а затем расщепляются лизосомальными ферментами. Холестерин, освобождающийся из остаточных хиломикронов и других липопротеинов, включается в общий фонд этого стероида в организме, снижая при этом синтез в печени эндогенного холестерина и ЛНП-рецепторов. Тканями, в которых идет значимый для организма синтез холестерина, являются печень, кишечник, кора надпочечников, кожа и репродуктивные органы, а также плацента. Около 80% этого стероида образуется в печени, которая использует его не только для собственных нужд, но и транспортируется в другие органы и ткани в составе липопротеинов.
СИНТЕЗ ХОЛЕСТЕРИНА
Протекает в основном в печени на мембранах эндоплазматического ретикулума гепатоцитов. Этот холестерин - эндогенный. Происходит постоянный транспорт холестерина из печени в ткани. Для построения мембран используется также пищевой (экзогенный) холестерин. Ключевой фермент биосинтеза холестерина - ГМГ-редуктаза (b-гидрокси, b-метил, глутарил-КоА редуктаза). В процессе синтеза холестерина можно условно выделить три этапа (рис. 15)
Образование мевалоната из 3 остатков ацетил-КоА.Ацетил-КоА доставляется в цитоплазму в виде цитрата. Начальная последовательность реакций сходна с реакциями синтеза кетоновых тел, которые в отличие от синтеза холестерина протекают в митохонд-риях. В цитозоле каждая молекула ГМГ-КоА восстанавливается ГМГ-КоА-редуктазой (b-гидрокси, b-метил, глутарил-КоА редуктаза)в мевалонат с использованием 2 молекул NADPH+H+. Эта реакция является основной регуляторной и лимитирует скорость данного метаболического пути.
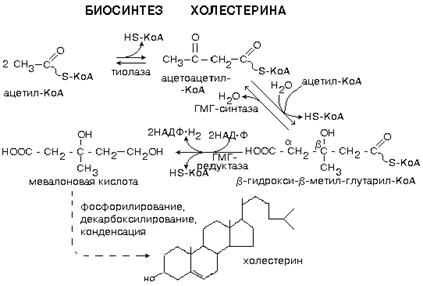
Рисунок 15
Образование сквалена 6 молекулами мевалоната. В ходе этого этапа из молекул мевалоната (с затратой 3 молекул АТР на 1 молекулу мевалоната) образуются фосфорилированные 5-углеродные изопреноидные производные — изопентенилпирофосфаты, конденсация которых приводит к образованию 30-углеродного соединения — сквалена.
Сквален превращается в холестерин. Сквален циклизуется с образованием полициклического ядра ланостерина, модификация которого сопровождается потерей 3 углеродных атомов, ведет к образованию холестерина.
Все промежуточные реакции синтеза холестерина до образования сквалена протекают в цитозоле клеток. Сквален и последующие метаболиты в водных средах нерастворимы и образуются в мембранном слое эндоплазматического ретикулума с участием ферментов микросомального окисления.
Ключевой регуляторной реакцией синтеза холестерина является превращение ГМГ-КоА в мевалонат. Эту реакцию катализируетГМГ-КоА-редуктаза, активность которой в тканях может варьировать в широких пределах. Она регулируется:
1. по механизмуфосфорилирования-дефосфорилирования, зависящему от соотношения гормонов инсулин/глюкагон. В фосфорилированной форме ГМГ-КоА-редуктаза полностью не активна;
2. изменением количества фермента, которое контролируется на уровне экспрессии гена. Холестерин, некоторые его оксипроизводные (25-оксихолестерин, 24,25-эпоксихолестерин), кортикостероиды являются низкомолекулярными корепрессорами транскрипции гена ГМГ-КоА-редуктазы.
В промоторной части гена обнаружены участки, к которым присоединяются белки, связан холестерином или его оксипроизводными и блокирующие синтез фермента. Активаторами синтеза ГМГ-КоА-редуктазы являются эстрогены.
Аллостерическое ингибирование ГМГ-редуктазы холестерином не установлено, хотя с холестерина подавляется холестерином ЛНП, поступающим в клетки через ЛНП-рецепторы, и мевалоновой кислотой. В течение дня синтез холестерина и активность ГМГ-КоА-редуктазы варьируют. Холестерин пищи снижает синтез холестерина в печени, но не влияет на биосинтез холестерина в кишечнике.
Дата добавления: 2015-09-18; просмотров: 2363;
