Энергетикалық деңгейлер. Кванттық сандар. Паули принципі.
Бор теориясы «рұқсат» етілген стационар орбиталардың  радиустарын есептеп табуға мүмкіндік береді. (4) өрнекке сәйкес
радиустарын есептеп табуға мүмкіндік береді. (4) өрнекке сәйкес  тек дискретті мәндер қабылдайды. Бұлар
тек дискретті мәндер қабылдайды. Бұлар  арқылы белгіленген. Сутегі атомындағы электронның ең кіші радиусын табу үшін (4) формулаға
арқылы белгіленген. Сутегі атомындағы электронның ең кіші радиусын табу үшін (4) формулаға  мәндерін қоямыз сонда
мәндерін қоямыз сонда 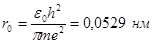 шығады. Бұл Бор радиусы деп аталады. Бұл мән газдардың кинетикалық теориясынан алынған деректермен жақсы үйлеседі. Сонымен Бор теориясы атомдардың мөлшері үшін дұрыс мәндер береді.
шығады. Бұл Бор радиусы деп аталады. Бұл мән газдардың кинетикалық теориясынан алынған деректермен жақсы үйлеседі. Сонымен Бор теориясы атомдардың мөлшері үшін дұрыс мәндер береді.
Енді сутегі атомының мүмкін энергетикалық деңгейлерін анықтайық. Электрон ядродан шексіз қашықтықта болғанда оның потенциалдық энергиясын нөл деп аламыз. Осы жағдайда заряды +Ζе ядродан 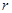 қашықтықтағы электронның
қашықтықтағы электронның  кинетикалық және
кинетикалық және  потенциалдық энергияларын жеке есептеп табуға болады:
потенциалдық энергияларын жеке есептеп табуға болады:
 .
.
Ал электронның толық энергиясы мынаған тең.
 . (11)
. (11)
Бұдан электрон энергиясы 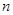 кванттық санына тәуелді екенін көруге болады, ал
кванттық санына тәуелді екенін көруге болады, ал 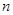 =1, 2, 3,... мәндерін қабылдайды. Демек атомның дискретті энергия мәндері бар кұйлері ғана болуы мүмкін. Мұндағы минус таңбасы жүйенің байланысқа не екенін көрсетеді. Сонымен атом энергиясы квантталған деген қорытынды жасауға болады.
=1, 2, 3,... мәндерін қабылдайды. Демек атомның дискретті энергия мәндері бар кұйлері ғана болуы мүмкін. Мұндағы минус таңбасы жүйенің байланысқа не екенін көрсетеді. Сонымен атом энергиясы квантталған деген қорытынды жасауға болады.
Атом ішіндегі электронның күйін сипаттау үшін n, l, ms, ml кванттық сандарын қолдануға болады. бас кванттық сан (n) энергия деңгейлерін анықтайды. Қосымша кванттық сан (l) электронның орбиталық қозғалыс мөлшері моментін сипаттайды; магниттік кванттық сан (ml ) болса, орбиталық қозғалыс мөлшері моментінің магнит өрісі бағытына түсірілген проекциясын сипаттайды; ал спиндік магниттік кванттық сан (ms) электронның меншікті қозғалыс мөлшері моментінің өріс бағытына түсірілген проекциясын анықтайды.
Паулидың зерттеуінше бір атомның ішінде осы n, l, ms, ml кванттық сандарының мәндері бірдей екі электрон болуы мүмкін емес. Басқаша айтқанда, бір атомның ішінде екі электрон бір мезгілдебірдей күйде бола алмайды. Бұл Паули принципі (1925 ж).
Егер электрондардың n, l, ml кванттық сандары бірдей болса, онда Паули принципі бойынша олардың ms кванттық саны бірдей болмауы тиіс, ал бұл кванттық санның мәне екі түрлі: ms=+1/2 және : ms=-1/2. Демек атомның ішінде n, l, ml кванттық сандары бірдей екі электрон бола алады. Енді электрондардың n, l кванттық сандары ғана бірдей болсын, онда мұндай электрондардың ml кванттық сандары бірдей болмауы тиіс. Ал l кванттық санның берілген бір мәніне сәйкес келетін ml кванттық санның (2l+1) мәндері болады; n, l, ml кванттық сандарының әрбір мәніне ms кванттық санының екі түрлі мәні сәйкес келеді. Сонда атомның ішінде n және l кванттық сандары бірдей көп дегенде 2(2l+1) электрон бола алады. Енді атомның ішінде бас кванттық саны бірдей қанша электрон болуы мүмкін, соған тоқталайық. Бас кванттық санның берілген бір n мәніне сай l кванттық санның мәндері 0, 1, 2,...(п-1) болатыны мәлім. Сондықтан бас кванттық сандары бірдей электрондардың ең көп мүмкін саны (Zn) мына қосындымен өрнектеледі:
 . (12)
. (12)
Бас кванттық саны бірдей электрондар тобы белгілі электрондық қабаттар немесе электрондық қабықтар түзеді. Олар K, L, M, N O, P, Q.... әріптерімен белгіленеді, сонда бас кванттық саны п=1 электрондар K-қабатын; бас кванттық сан п=2 электрондар L-қабатын; бас кванттық саны п=3 электрондар M-қабатын; бас кванттық саны п=4 электрондар N-қабатын; бас кванттық саны п=5 электрондар O-қабатын; бас кванттық саны п=6 электрондар P-қабатын түзеді. Сонда K, L, M, N O... қабаттарында ретімен алғанда (12) формулаға лайық ең көбі, 2, 8, 18, 32, 50 электрон болады. Әрбір қабаттағы қосымша кванттық саны бірдей электрондар электрондық қабатшалар түзеді. Сөйтіп әрбір электрондық қабат бірнеше қабатшаларға бөлінеді, қосымша кванттық сан l =0, 1, 2, 3, болса, олар s, p, d, f, g,…әріптерімен белгіленеді. Әрбір қабатшада ең көп болғанда 2(2l+1) электрон болады; сонда s-қабатшада ең көбі2 электрон, p- қабатшада ең көбі6 электрон, d- қабатшада ең көбі10 электрон, f- қабатшада ең көбі14 электрон бола алады.
Студенттердің өзін-өзі тексеруге арналған сұрақтары:
1. Сутегі атомы үшін стационарлық орбиталар радиусының өрнегі қандай?
2. Электронның орбита бойынша айналу жиілігі қалай өрнектеледі?
3. Сутегіге ұқсас атомдар қандай атомдар?
4. Қандай квантық сандарды білесіз?
5. Паули принципінің мәнін түсіндіріңіз.
Дата добавления: 2015-09-18; просмотров: 8476;
