Атомның құрылысы. Атомдық спектрлер
ХХ ғасырдың бас кезінде атомның шын бар екендігі ешқандай күмәнсіз жалпылай мойындалды. Атомдар реттік шамасы 10-10 м болатын электрлік жүйе құрайтындығы тағайындалды. Енді күн тәртібінде атом құрылымы қандай деген мәселе қойылды. Атом құрылысы туралы бірқатар пікірлер айтылды, атомның модельдері ұсынылды.
Томсон моделі. Атом оң зарядталған атомның негізгі массасымен байланысқан бөліктен және жеңіл теріс зарядталған электрондардан тұратындығы тағайындалғаннан атомның статистикалық моделін құруға әрекеттер жасалды. Соның бірі ағылшын физигі Дж. Дж. Томсон ұсынған атом моделі (1902-04). Бұл атомның күрделі құрамы жөніндегі белгілі ғылыми деректерге сүйеніп ұсынылған атомның алғашқы физикалық моделі. Бірақ бұл модель тікелей тәжірибеге негізделмегендіктен болжау ғана еді. Осы модельге сәйкес атомның оң заряды сфера тәріздес атомды біркелкі толтырып тұруға тиіс, ал оның ішінде нүктелік теріс зарядтар – электрондар атом бүтіндей бейтарап болатындай мөлшерде сфераның әр жерінде орналасқан болады.
Томсон моделі Лоренцтің классикалық электрондық теориясымен үйлесім тапты; осы теорияға сәйкес атомдар гармоникалық осциллятор болып табылады (атом-осциллятор моделі). Атом-осцилляторда зеріс зарядталған бөлшектер (электрон) электромагниттік жарық толқындары әсерінен гармоникалық тербелістер жасауға қабілетті деп саналды. Ал Томсон моделіне сәйкес атом ішіндегі электронға квазисерпімді күш әсер етеді де, ол гармоникалық тербелістер жасай алады. Осылай қабылдау арқылы заттың көптеген оптикалық қасиеттерін, мысалы, атомның монохромат жарық шығаруын түсіндіру, жарық дисперсиясын, яғни сыну көрсеткішінің жиілікке тәуелділігін түсіндіру мүмкін болды.
Мұны Томсон моделінің расталуы ретінде қарастыруға болар еді. Бірақ кейіннен осы модельдің жарамсыздығы анықталды. Томсон моделіне сәйкес атом 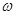 негізгі жиілікті және оның 2
негізгі жиілікті және оның 2 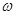 , 3
, 3 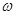 , ... гармоникаларын шығара алады. Бұл тәжірибеге қайшы. Тұтас алғанда Томсон моделі көптеген күдік туғызды. Мысалы, оң зарядталған атом сферасының материялық табиғаты түсініксіз болды; спектрлік заңдылықтарды және толып жатқан басқа құбылыстарды түсіндіре алмады.
, ... гармоникаларын шығара алады. Бұл тәжірибеге қайшы. Тұтас алғанда Томсон моделі көптеген күдік туғызды. Мысалы, оң зарядталған атом сферасының материялық табиғаты түсініксіз болды; спектрлік заңдылықтарды және толып жатқан басқа құбылыстарды түсіндіре алмады.
Резерфорд тәжірибелері.Томсон моделіндегі қайшылықтарды атом қойнауын әйтеуәр бір амалмен тікелей барлап қарау арқылы шешуге болатын еді. Міне осындай тәжірибені ағылшын физигі Э. Резерфорд (1871-1937) және оның шәкірттері Г. Гейгер, Э. Марсден жүргізді (1909-1910 ж.ж.). Тәжірибелер Томсон моделінің келісімсіздігін көрсетті. Осы тәжірибелер нәтижелеріне сүйеніп, Э. Резерфорд атомның жаңа ядролық моделін ұсынды (1911).
Резерфорд былай ұйғарды: атом өте кішкентай, бірақ ауыр, оң зарядталған ядродан (мұнда атом массасының 99,9 % шоғырланған) және оны қайсыбір қашықтықта қоршаған электрондардан тұрады. Электрондар ядроны айналып қозғалуы тиіс болды (күнді айналатын планеталар сияқты), өйткені, егер олар тыныштықта болса, онда электрлік кулондық тарту әсерінен ядроға құлаған болар еді. Резерфордтың бағалауы бойынша ядро мөлшерінің реттік шамасы 10-15-10-14 м болуға тиіс. Кинетикалық теориядан, әсіресе Эйнштейннің броундық қозғалысты талдау жүргізуінен атом мөлшерінің реттік шамасы 10-10 м болып бағаланады. Бұдан электрондар ядродан шамамен 104-105 ядро диаметріндей қашықтықта болуға тиіс, яғни атомның басым бөлігі бос кеңістік болады.
Сонымен, егер ядро радиусы атом радиусынан шамамен 105 есе кіші болса, онда ядро маңындағы электр өрісінің кернеулігі Томсон моделінің атомы бетіндегі өріс кернеулігінен шамамен 1010 есе үлкен болуға тиіс. Электр өрісі кернеулігінің осындай болуы 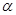 -бөлшектердің үлкен бұрыштарға, соның ішінде тиісті кері бағытта шашырауын мүмкін етеді.
-бөлшектердің үлкен бұрыштарға, соның ішінде тиісті кері бағытта шашырауын мүмкін етеді.
Резерфорд тәжірибелерінде оң зарядталған ядро анықталғаннан кейін енді электрондар атомның қай жерінде болады, ал қалған кеңістік немен толтырылған деген сұраққа жауап беру керек болды. Резерфорд атомның құрылысы планеталар жүйесіне ұқсас деген жорамал ұсынды. Күннің айналасында үлкен қашықтықтарда планеталар қалай айналып жүретін болса, дәл солай атомның ішінде электрондар ядроны айналып жүреді. Ядродан ең алыс электрон орбитасының радиусы – атомның радиусы болады. Атом құрылысының осындай моделі планетарлық немесе ядролық модель деп аталды.
Резерфорд тәжірибелері атомның ядролық «планетарлық» моделін растайды: атом центрінде оң зарядталған ауыр ядро болады, оның айналасында, күннің айналасындағы планеталар сияқты, зарядталған жеңіл электрондар айналып жүреді.
Атомдардың сәуле шығару спектрлері атомдардың оптикалық қасиеттерінің маңызды сипаттамалар – жеке спектрлік сызықтардан немесе жақын орналасқан сызықтар топтарынан тұрады; бұларды сызықтық спектрлер деп атайды.
Ең қарапайым спектрлердің бірі сутегі атомының спектрі болады. Өйткені сутегінің атомы ең қарапайым атом болады. Спектрдің көрінетін бөлігінде сутегінің тек 4 сызығы бар, олар Нα, Нβ, Нγ және Нδ сызықтары (2-сурет). Осы сызықтардың толқын ұзындықтарын бір формуламен өте дәл өрнектеуге болады. Оны 1885 ж. ең алғаш Швейцариялық ғалым И. Бальмер тағайындаған. 1890 швед ғалымы И. Ридберг бұл формуланы басқа түрде жазуды ұсынған. Сонда:
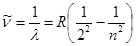 , (3)
, (3)
мұндағы 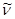 – спектрлік сызықтың толқындық саны, см-1,
– спектрлік сызықтың толқындық саны, см-1, 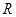 – Ридберг тұрақтысы, оның сан мәні 109677,581 см-1, n=3, 4, 5, 6,….
– Ридберг тұрақтысы, оның сан мәні 109677,581 см-1, n=3, 4, 5, 6,….
Бальмер формуласы қамтитын сутегі атомының спектрлік сызықтарының тобы Бальмер сериясы деп аталады. Одан басқа да сериялар бар. Спектрдің ультракүлгін бөлігіндегі бір топ сызықтар Лайман(1906) сериясы деп аталады:
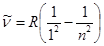 , n=2, 3, 4, ….
, n=2, 3, 4, ….
Сутегі спектрінің жақын инфрақызы бөлігінде Пашен (1908) сериясы деп аталатын бір топ сызықтары мына формуламен өрнектеледі:
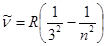 , n=4, 5, 6,….
, n=4, 5, 6,….
Бұдан басқа спектрдің алыс инфрқызыл бөлігінде үш серия бар. Олар:
Брэкет сериясы (1922): 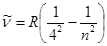 , n=5, 6, 7,...
, n=5, 6, 7,...
Пфунд сериясы (1924): 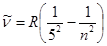 , n=6, 7, 8,...
, n=6, 7, 8,...
Кэмфри сериясы (1953): 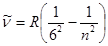 , n=7, 8, 9,...
, n=7, 8, 9,...
Сонымен сутегі атомының барлық спектрлік сызықтарын сынадай жалпы формуламен өрнектеуге болады:
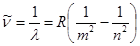 , (4)
, (4)
мұндағы 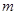 және
және 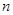 – бүтін сандар және
– бүтін сандар және 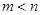 .
.
Дата добавления: 2015-09-18; просмотров: 8938;
