Примеры решения задач. Пример 7.1. Водный раствор содержит 354 г H3PO4 в 1 л
Пример 7.1. Водный раствор содержит 354 г H3PO4 в 1 л. Плотность раствора ρ = 1,18 г/мл. Вычислить: а) массовую долю (%) H3PO4 в растворе;
б) молярную концентрацию; в) молярную концентрацию эквивалентов;
г) моляльность; д) титр; е) молярные доли H3PO4 и Н2О.
Решение. а) Для расчета массовой доли воспользуемся формулой
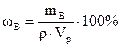 :
:  %
%
б) Молярная концентрация вещества В или молярность(сВ или М) – отношение количества растворенного вещества к объему раствора:
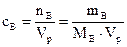 , моль/л, (1)
, моль/л, (1)
где nB – количество вещества В, моль; mB – масса вещества В, г; МВ – молярная масса вещества В, г/моль; Vр – объем раствора, л.
Молярная масса H3PO4 равна 98 г/моль. Молярную концентрацию раствора находим из соотношения (1):
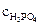 =
= 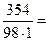 3,61 моль/л.
3,61 моль/л.
в) Молярную концентрацию эквивалентов рассчитываем по формуле 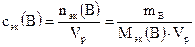 . Молярная масса эквивалентов H3PO4 равна
. Молярная масса эквивалентов H3PO4 равна
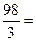 32,7 г/моль.
32,7 г/моль. 
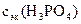 =
= 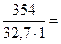 10,83 моль/л.
10,83 моль/л.
г) Моляльная концентрация вещества В или моляльность(сm(B)) – отношение количества растворенного вещества к массе растворителя:
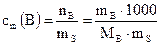 , моль/кг, (2)
, моль/кг, (2)
где nВ – количество вещества В, моль; mB – масса вещества В,г; mS – масса растворителя, г; МВ − молярная масса вещества В, г/моль.
Для определения моляльности по формуле (2) необходимо рассчитать массу растворителя в растворе. Масса раствора составляет 1,18 ∙ 1000 = 1180 г.
Масса растворителя в растворе mS = 1180 – 354 = 826 г.
Моляльная концентрация раствора равна:
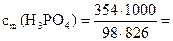 4,37 моль/кг
4,37 моль/кг
д) Титр раствора можно рассчитать по формулам:
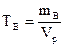 :
: 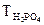 =
= 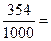 0,354 г/мл,
0,354 г/мл,
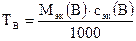 :
: 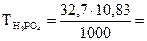 0,354 г/мл,
0,354 г/мл,
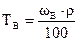 :
: 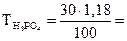 0,354 г/мл.
0,354 г/мл.
е) Молярная (мольная) доля вещества В(хВ, безразмерная величина ) ─ отношение количества данного вещества к суммарному количеству всех веществ, составляющих раствор, включая растворитель.
Если раствор состоит из одного растворенного вещества и растворителя, то молярная доля вещества (хВ) равна:
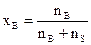 , (3)
, (3)
а молярная доля растворителя (хs):
 , (4)
, (4)
где nB – количество растворенного вещества, моль; nS – количество вещества растворителя, моль.
Сумма молярных долей всех веществ раствора равна единице.
В 1 л раствора содержится 3,61 моль H3PO4 (см. пункт б). Масса растворителя в растворе 826 г, что составляет 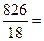 45,9 моль.
45,9 моль.
Молярные доли H3PO4 и Н2О рассчитываем по формулам (3) и (4):
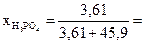 0,073;
0,073;
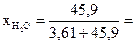 0,927.
0,927.
Пример 7.2. Сколько миллилитров 50 %-ного раствора HNO3, плотность которого 1,32 г/мл, требуется для приготовления 5 л 2 %-ного раствора, плотность которого 1,01 г/мл?
Решение. При решении задачи пользуемся формулой 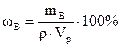 . Сначала находим массу азотной кислоты в 5 л 2 %-ного раствора:
. Сначала находим массу азотной кислоты в 5 л 2 %-ного раствора:
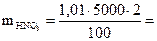 101 г.
101 г.
Чтобы ответить на вопрос задачи, надо определить, в каком объеме раствора с массовой долей HNO3 50 % содержится 101 г HNO3:
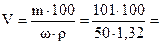 153 мл
153 мл
Таким образом, для приготовления 5 л 2 %-ного раствора HNO3 требуется 153 мл 50 %-ного раствора HNO3.
Пример 7.3. На нейтрализацию 50 мл раствора  кислоты израсходовано
кислоты израсходовано
25 мл 0,5 н раствора щелочи. Чему равна нормальность кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных количествах, то можно написать
VA ∙ cэк (А) = VB ∙ сэк (B)
50 ∙ сэк (кислоты) = 25 ∙ 0,5, отсюда
сэк (кислоты) = 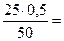 0,25 моль/л
0,25 моль/л
Следовательно, для реакции был использован 0,25 н раствор кислоты.
Задачи
№ 7.1. В одном литре раствора содержится 10,6 г карбоната натрия Na2CO3. Рассчитать молярную концентрацию, молярную концентрацию эквивалентов и титр раствора. (Ответ: 0,1 М; 0,2 н; 10,6∙10-3 г/мл)
№ 7.2. Вычислить молярную концентрацию и молярную концентрацию эквивалентов 20 %-ного раствора хлорида кальция плотностью 1,178 г/мл.
(Ответ: 2,1 М; 4,2 н).
№ 7.3. Сколько моль HNO3 содержится в 250 мл раствора с массовой долей кислоты 30 % и плотностью, равной 1,18 г/мл? (Ответ: 1,40 моль).
№ 7.4. Водный раствор содержит 5 г CuSO4 в 45 г воды. Плотность раствора равна 1,107 г/мл. Вычислить массовую долю (%) CuSO4 в растворе, а также моляльность и мольные доли CuSO4 и Н2О.
(Ответ: 9 %; 0,694 моль/кг; 0,012; 0,988).
№ 7.5. Вычислить титры растворов: а) 0,05 М NaCl; б) 0,004 н Ca(OH)2;
в) 30 %-ного КОН, ρ = 1,297 г/мл.
(Ответ: а) 0,00292 г/мл; б) 0,148 ∙ 10‾3 г/мл; в) 0,389 г/мл).
№ 7.6. Чему равна нормальность 30 %-ного раствора NaOH плотностью 1,328 г/мл? К 1 л этого раствора прибавили 5 л воды. Получился раствор плотностью 1,054 г/мл. Вычислить массовую долю (%) NaOH в полученном растворе. (Ответ: 9,96 н; 6,3 %).
№ 7.7. В 1 кг воды растворили 666 г КОН, плотность раствора равна 1,395 г/мл. Вычислить массовую долю КОН в полученном растворе, молярность и мольные доли щелочи и воды. (Ответ: 40 %; 9,96 моль/л; 0,176; 0,824).
№ 7.8. Какой объем 2 М раствора К2СО3 надо взять для приготовления 1 л 0,25 н раствора? (Ответ: 62,5 мл).
№ 7.9. Из 600 г 5 %-ного раствора сульфата меди упариванием удалили 100 г воды. Чему равна массовая доля CuSO4 в оставшемся растворе? (Ответ: 6 %).
№ 7.10. Какой объем 50 %-ного КОН (ρ = 1,538 г/мл) требуется для приготовления 3 л 6 %-ного раствора (ρ = 1,048 г/мл)? (Ответ: 245,3 мл).
№ 7.11. Из 5 л раствора гидроксида калия с массовой долей КОН 50 % и плотностью 1,538 г/мл надо приготовить раствор с массовой долей КОН 18 %. Какой объем воды потребуется? (Ответ: 17,5 л).
№ 7.12. Вычислить моляльную и молярную концентрацию эквивалентов 20,8 %-ного раствора HNO3 плотностью 1,12 г/мл. Сколько граммов кислоты содержится в 4 л этого раствора? (Ответ: 4,17 моль/кг; 3,7 н; 931,84 г).
№ 7.13. Сколько миллилитров 0,2 М раствора Na2CO3 требуется для реакции с 50 мл 0,5 М раствора CaCl2? (Ответ: 125 мл).
№ 7.14. Плотность 15 %-ного раствора Н2SO4 1,105 г/мл. Вычислить молярность, моляльность и молярную концентрацию эквивалентов раствора серной кислоты. (Ответ: 1,69 моль/л; 1,8 моль/кг; 3,38 моль/л).
№ 7.15. Сколько миллилитров раствора соляной кислоты с плотностью 1,195 г/мл, содержащей 38 % HCl, нужно для приготовления 1 л 2 н раствора?
(Ответ: 160,7 мл).
№ 7.16. При растворении 18 г Н3РО4 в 282 мл воды получили раствор фосфорной кислоты, плотность которого 1,031 г/мл. Вычислить молярную, моляльную, молярную концентрацию эквивалентов полученного раствора и его титр. (Ответ: 0,63 М; 0,65 моль/кг; 1,89 н; 0,062 г/мл).
№ 7.17. На нейтрализацию 20 мл раствора, содержащего в 1 л 12 г щелочи, израсходовано 24 мл 0,25 н раствора кислоты. Вычислить молярную массу эквивалентов щелочи. (Ответ: 40 г/моль).
№ 7.18. На нейтрализацию 31 мл 0,16 н раствора щелочи требуется 217 мл раствора H2SO4. Вычислить нормальность и титр раствора H2SO4.
(Ответ: 0,023 н; 1,127∙10‾3 г/мл).
№ 7.19. Смешали 10 мл 10 %-ного раствора HNO3 (ρ = 1,056 г/мл) и 100 мл
30 %-ного раствора HNO3 (ρ = 1,184 г/мл). Вычислить массовую долю HNO3 в полученном растворе. (Ответ: 28,36 %).
№ 7.20. Вычислить массовую долю (%) нитрата серебра в 1,4 М растворе, плотность которого 1,18 г/мл. (Ответ: 20,2 %).
Дата добавления: 2015-09-11; просмотров: 10048;
