Выполнение работы. Опыт 1. Приготовление приблизительно 0,1 н раствора соляной кислоты
Опыт 1. Приготовление приблизительно 0,1 н раствора соляной кислоты
Налить (под тягой) в цилиндр концентрированный раствор соляной кислоты и ареометром определить его плотность. По измеренной плотности по таблице 1 найти массовую долю (%) кислоты в растворе. Рассчитать массу кислоты, необходимую для приготовления 250 мл 0,1 н раствора HCl по формуле:
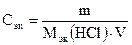 , откуда m = сэк · Мэк (HCl) · V,
, откуда m = сэк · Мэк (HCl) · V,
где m – масса кислоты, г; Мэк (HCl) – молярная масса эквивалентов кислоты, г/моль; сэк – молярная концентрация эквивалентов, моль/л; V – объем кислоты, л.
Полученную величину (m) пересчитать на объем, который требуется для приготовления 250 мл 0,1 н раствора кислоты по формуле:
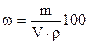 , откуда V =
, откуда V = 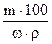 ,
,
где V – объем кислоты, мл; m – масса кислоты,г; ω – массовая доля в % HCl, найденная по таблице 1; ρ – плотность кислоты, г/см3, измеренная ареометром.
Пипеткой отобрать рассчитанный объем раствора кислоты, перенести его в мерную колбу, разбавить водой до метки и хорошо перемешать.
Опыт 2. Установление нормальности и титра кислоты
Отмерить пипеткой 10 мл приготовленного раствора кислоты, перенести его в коническую колбу, добавить 1-2 капли фенолфталеина.
В бюретку налить 0,1 н раствор NaOH. Оттитровать раствор кислоты. Для этого медленно приливать из бюретки щелочь в колбу с раствором кислоты, непрерывно перемешивая его в процессе титрования. Место, в которое падают капли щелочи, окрашивается в розовый цвет, исчезающий при взбалтывании. Титрование проводить до тех пор, пока от одной капли щелочи раствор примет неисчезающую окраску. Титрование повторить. Результаты не должны отличаться более чем на 0,1 мл.
Требования к результату опыта:
Данные опыта занести в таблицу:
Данные опыта и результаты расчетов Таблица 7.1
| № п/п | V (HCl) (объем кислоты) | V (NaOH) (объем щелочи) | Vср (NaOH) (среднее значение объема щелочи) |
Вычислить:
1. Молярную концентрацию эквивалентов раствора кислоты по закону эквивалентов:
сэк (HCl)∙V(HCl) = сэк (NaOH)∙V (NaOH), откуда
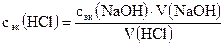 , моль/л
, моль/л
где сэк (HCl) и сэк (NaOH) – молярные концентрации эквивалентов растворов; V(HCl) и V(NaOH) – объемы реагирующих растворов.
2. Титр раствора НСl по формуле:
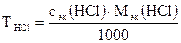 , г/мл
, г/мл
Плотность раствора соляной кислоты Таблица 7.2
| Плотность ρ, г/см3 | Массовая доля кислоты, % |
| 1,100 | 20,01 |
| 1,105 | 20,97 |
| 1,110 | 21,92 |
| 1,115 | 22,86 |
| 1,120 | 23,82 |
| 1,125 | 24,78 |
| 1,130 | 25,75 |
| 1,135 | 26,70 |
| 1,140 | 27,66 |
| 1,145 | 28,61 |
| 1,150 | 29,57 |
| 1,155 | 30,55 |
| 1,160 | 31,52 |
| 1,165 | 32,49 |
| 1,170 | 33,46 |
| 1,175 | 34,42 |
| 1,180 | 35,39 |
| 1,185 | 36,31 |
| 1,190 | 37,23 |
| 1,195 | 38,16 |
| 1,200 | 39,11 |
Дата добавления: 2015-09-11; просмотров: 3223;
